
(14分)金属钛素有“太空金属”、“未来金属”等美誉。工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4·7H2O(绿矾)的工艺流程如下图所示。
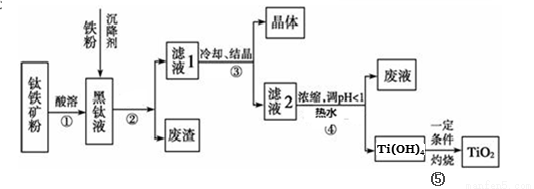
已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价。
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:_________;
步骤②中,加入铁粉的主要目的是 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼 烧”所需主要仪器有 。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4 的原因:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 。
(6)实验室通过下面方法可测定副产品绿矾中FeSO4·7H2O的质量分数。
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O 未配平 )。
计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留二位小数)。
(14分)(1)FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O; (2分)
将Fe3+转化为Fe2+并防止Fe2+被氧化 (2分)
(2)b (1分)
(3)过滤 (1分) 坩埚(酒精灯、三脚架、泥三角不填不扣分,填错扣分,“坩埚”错别字不给分)(2分)
(4)溶液中存在平衡:TiO2+ + 3H2O  Ti(OH)4 + 2H+,当加入热水稀释、升温后,
Ti(OH)4 + 2H+,当加入热水稀释、升温后,
平衡正向移动,生成Ti(OH)4。 (2分)
(5)MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O (2分)
(6) 0.93(2分)
【解析】
试题分析:(1)钛铁矿主要成分为钛酸亚铁(FeTiO3),酸溶后得TiO2+和Fe2+,所以步骤①化学反应方程式为:FeTiO3+2H2SO4===FeSO4+TiOSO4+2H2O;因为一部分铁元素在钛铁矿处理过程中会转化为+3价,所以加入铁粉目的是将Fe3+转化为Fe2+并防止Fe2+被氧化;
(2)步骤③中,冷却、结晶将物质分离,是利用了物质的溶解性的不同,所以答案选b;
(3)步骤②、③、④中都是固、液分离,所以涉及到的操作是过滤;步骤⑤“灼烧”所需主要仪器有坩埚、酒精灯、三脚架、泥三角;
(4)步骤④溶液中存在平衡:TiO2+ + 3H2O  Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。
Ti(OH)4 + 2H+,水解反应是吸热反应,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4。
(5)废液中含有未结晶的Fe2+,与二氧化锰发生氧化还原反应,生成Fe3+、Mn2+ ,离子方程式为MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O ;
(6)根据得失电子守恒规律,n(FeSO4·7H2O)=5n(KMnO4),250mL的溶液中n(FeSO4·7H2O)=19.00×10-3L×0.01mol/L×10×5=9.5×10-3mol,所以绿矾样品中FeSO4·7H2O的质量分数为9.5×10-3mol×278g/mol÷2.85g=0.93。
考点:考查对工业流程的分析,仪器的选择,化学平衡的移动,化学方程式、离子方程式的书写,氧化还原反应的计算,操作判断


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:选择题
下列物质中,属于同素异形体的是
A.S2和S4 B.CO和CO2 C. 和
和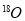 D.H2和D2
D.H2和D2
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
下列物质中,既能与盐酸反应,又能与KOH溶液反应的是
①NaHCO3 ②AgNO3 ③(NH4)2S
④HOOC-COONa ⑤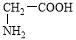 ⑥
⑥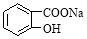
A.全部 B.①②④⑤⑥ C.②③④⑤⑥ D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
实验室制备,收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器口顺序为a接( )接( )接( )接( )接f(填接口字母) ( )

A.b c d e B.d e b c C.d e c b D.e d b c
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型图正确的是
A.H2O2的电子式: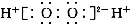 B.CH4的球棍模型:
B.CH4的球棍模型:
C.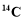 的原子结构示意图:
的原子结构示意图: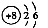 D.CCl4的结构式:
D.CCl4的结构式: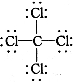
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省六市毕业班第二次联合调研检测理综化学试卷(解析版) 题型:选择题
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃 料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,关于该电池描述正确的是

A.电池工作时H+移向负极
B.该装置还可以将电能转化成为化学能
C.理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2
D.电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+
查看答案和解析>>
科目:高中化学 来源:2013-2014河南师大附中高三4月份月考理综化学试卷(解析版) 题型:填空题
(13分)硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
(1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、、Na2SO4、NaHSO4 |
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。

①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 。
②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2 沸点—10℃。)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 。
③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省邯郸市高二7月调研考试化学试卷(解析版) 题型:选择题
根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )
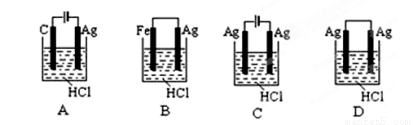
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省高二下学期第三次月考化学试卷(解析版) 题型:选择题
下列除杂质的方法中正确的是( )
A.乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液
B.乙烷中混有乙烯,通入H2,在一定条件下反应使乙烯完全转化成乙烷
C.苯甲醛中混有苯甲酸,加入生石灰后,再加热蒸馏
D.溴苯中含有单质溴加入KI溶液后用分液漏斗分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com