
科目:高中化学 来源:2014高考名师推荐化学常见有机物性质与结构(解析版) 题型:选择题
香叶醇是合成玫瑰香油的主要原料,其结构简式如下,下列有关香叶醇的叙述正确的是
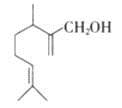
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:填空题
碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。各物质在不同温度下的溶解度见表。
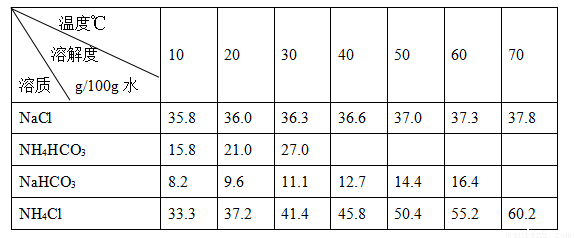
实验步骤
Ⅰ、化盐与精制:①粗盐(含Ca2+、Mg2+、SO42-)溶解;②加入足量NaOH和Na2CO3溶液,煮沸;③过滤;④加入盐酸调pH至7。
Ⅱ、转化:①将精制后的食盐溶液温度控制在30~35℃之间;在不断搅拌下,加入研细的碳酸氢铵;保温,搅拌半小时;②静置,a 、b ;③得到NaHCO3晶体。
Ⅲ、制纯碱:将得的NaHCO3放入蒸发皿中,在酒精灯上灼烧,冷却到室温,即得到纯碱。
完成下列填空:
(1)“化盐与精制”可除去的粗盐中的杂质离子是 。
(2)“转化”的离子方程式是 。
(3)“转化”过程中,温度控制在30~35℃之间的加热方式是 ;为什么温度控制在30~35℃之间? 。
(4)a、b处的操作分别是 、 。
(5)实验室制得的纯碱含少量NaCl还可能含少量NaHCO3,为测定纯碱的纯度,用电子天平准确称取样品G克,将其放入锥形瓶中用适量蒸馏水溶解,滴加2滴酚酞,用c mol/L的标准盐酸滴定至溶液由浅红色变成无色且半分钟不变,滴定过程中无气体产生,所用盐酸的体积为V1mL。此时发生的反应为:
CO32-+H+→HCO3-
①样品中碳酸钠质量百分含量的表达式是 。
②向锥形瓶溶液中继续滴加2滴甲基橙,用同浓度的盐酸继续滴定至终点,所用盐酸的体积为V2mL。滴定终点时溶液颜色的变化是 ;根据实验数据,如何判断样品含NaHCO3 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
下列有关物质浓度关系的描述,正确的是
A.25 ℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25 ℃时,向0.1 mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(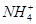 )>c(
)>c(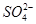 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
C.0.1 mol·L-1NaHCO3溶液中:c(OH-)+2c(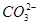 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:
c(CH3COONa)> c(Na2CO3)>c(C6H5ONa)>c(NaHCO3)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学基本营养物质(解析版) 题型:选择题
核糖是合成核酸的重要原料,结构简式为CH2OH—CHOH—CHOH—CHOH—CHO。下列关于核糖的叙述正确的是
A.与葡萄糖互为同分异构体
B.可以与银氨溶液作用形成银镜
C.可以跟氯化铁溶液作用显色
D.可以使紫色石蕊试液变红
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学周期表、核素(解析版) 题型:选择题
.我国稀土资源丰富。下列有关稀土元素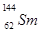 与
与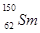 的说法正确的是
的说法正确的是
A. 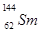 与
与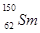 互为同位素
互为同位素
B. 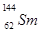 与
与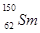 的质量数相同
的质量数相同
C. 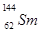 与
与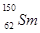 是同一种核素
是同一种核素
D. 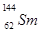 与
与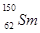 的核外电子数和中子数均为62
的核外电子数和中子数均为62
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学同分异构体的判断(解析版) 题型:选择题
碘单质难溶于水却易溶于KI溶液。碘水中加入KI溶液发生反应:I2(aq)+I-(aq)  I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
I(aq),该反应的平衡常数与温度的关系如图,下列说法不正确的是( )
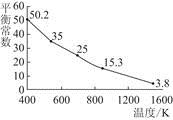
A.上述正反应为放热反应
B.上述体系中加入苯,平衡不移动
C.可运用该反应原理除去硫粉中少量的碘单质
D.实验室配制碘水时,为增大碘单质的溶解度可加入适量KI溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学原电池的工作原理、电极反应式的书写(解析版) 题型:选择题
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的是
A.正极的电极反应式:O2+4H++4e-=2H2O
B.溶液中的阴离子向正极移动
C.负极的电极反应式:N2H4+4OH--4e-=4H2O+N2
D.溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学化学平衡常数(解析版) 题型:填空题
A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如下图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列
问题:
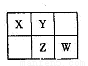
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3)AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高
反应速率,又能提高原料转化率的是 。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被200 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com