
����Ŀ���й���ѧԺ�ٷ�����2017��3�·���������ר�⡷�����������ϸ������ij����ַ�������ͼ��ʾ��
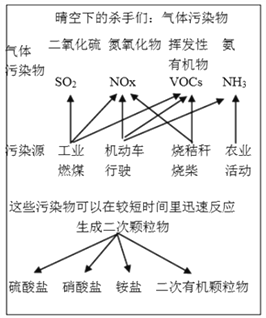
��1��������ͼ��Ϣ���Կ�������������������Ⱦ�������ɻ�������ʻ��ɵ�_______________��
a��SO2 b��NOx c��VOCs d�� NH3
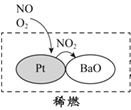
��2��������������ʻ����ȾԴ֮һ����������������ϡȼ����ϵͳ��Ҫ����ԭ����ͼ��ʾ��д��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽ_______________��
��3����ѧ�Ҿ����о������й��������ԣ�����Ҫԭ������ͼ��ʾ��
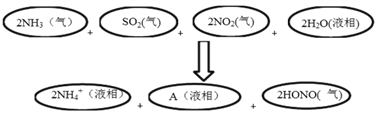
���ж�A�Ļ�ѧʽ��˵���ж����ɣ�_____________________________________________��
��4��úȼ���ŷŵ���������SO2��NOx������NaClO2��Һ��Ϊ���ռ���ͬʱ��������������������������SO2��NOx������ͨ��ʢ��NaClO2��Һ�ķ�Ӧ���У���Ӧһ��ʱ������Һ������Ũ�ȵ��й��������£��������Ӻ��Բ��ƣ���
���� | Na+ | SO42 | NO3 | H+ | Cl |
Ũ��/��mol��L1�� | 5.5��103 | 8.5��104 | y | 2.0��104 | 3.4��103 |
��SO2��NaClO2��Һ��Ӧ�����ӷ���ʽ��________________________________________��
�ڱ���y ��_______________��
���𰸡� a 2NO+O2=2NO2 SO42-����Ϊ��ӦǰS+4�ۣ�N+4�ۣ���Ӧ��HONO��NԪ��+3�ۣ����ϼ۽��ͣ������Ԫ�ػ��ϼ����ߣ���SԪ�ش�+4���ߵ�+6�ۣ���SO42-��ʽ���� 2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ 6��104
����������1������ʾ��ͼ��֪SO2�����ɻ�������ʻ��ɵģ��ʴ�Ϊa��
��2��ϡȼ������NO��������Ҫ��Ӧ�ķ���ʽΪ��2NO+O2=2NO2��
��3����ӦǰSԪ��Ϊ+4�ۣ�NԪ��Ϊ+4�ۣ���Ӧ��HONO��NԪ��Ϊ+3�ۣ����ϼ۽��ͣ��л��ϼ۵Ľ��ͣ�����Ԫ�ػ��ϼ����ߣ�������SԪ�ش�+4���ߵ�+6�ۣ���A����ΪSO42-������Ҳ�ɸ��������غ��Ƴ�A�Ļ�ѧʽΪSO42-���ʴ�Ϊ��SO42-����Ϊ��ӦǰS+4�ۣ�N+4�ۣ���Ӧ��HONO��NԪ��+3�ۣ����ϼ۽��ͣ������Ԫ�ػ��ϼ����ߣ���SԪ�ش�+4���ߵ�+6�ۣ���SO42-��ʽ���ڡ�
��4���� SO2���л�ԭ�ԣ� NaClO2����ǿ�����ԣ����߷���������ԭ��Ӧ�����ӷ���ʽΪ�� 2SO2+ClO2-+2H2O=2SO42-+Cl- +4H+ �� ����Һ�Ե����ԣ��������������������ֵ�������������ĸ������ֵ��ȣ���1��5.5��103+1��2.0��104=2��8.5��104+ y��1+1��3.4��103������y= 6��104��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ��ѺϽ��ں��չ�ҵ����Ҫ��Ӧ�á�ұ���ѵĹ����з�����Ӧ֮һ�ǣ�TiO2��2C��2Cl2===TiCl4��2CO������˵���������(����)
A. ����1 mol TiCl4ʱ��ת�Ƶ���4 mol B. C�ǻ�ԭ��
C. β�����뾻������ D. TiO2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�е�������Ũ����50 mL 1 mol��L��1���Ȼ�����Һ�е�������Ũ����ȵ���(����)
A. 150 mL 1 mol��L��1��NaCl B. 150 mL 1 mol��L��1��KCl
C. 75 mL 3 mol��L��1��NH4Cl D. 75 mL 2 mol��L��1��CaCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2��Cl2��Ư���ԣ���������µ�ʵ��װ�á�

��1��ʵ���ҳ������̿���Ҫ�ɷ���MnO2����Ũ�����ϼ��ȵķ����Ʊ�Cl2��д��ʵ�����Ʊ������Ļ�ѧ����ʽ��________________________________________________���ڴ˻�ѧ��Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ____________������Ӧ������ת�Ƶ��ӵ����ʵ���Ϊ6 mol�����������������ʵ���Ϊ____________mol��
��2����Ӧ��ʼһ��ʱ��� B��D�����Թ��е�Ʒ����Һ���ֵ������ǣ� B��_______________________�� D��________________________��
��3��ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȣ������Թ��е�����ֱ��ǣ�B��_______________________�� D��________________________��
��4��ʵ����NaOH��Һ��������________________________________________������C��NaOH��Һ����ˮ����ͨ�����ʵ�����Ϊ1:1��SO2��Cl2��ǡ�÷�Ӧ��������ǿ�ᣨ����һ���Ǻ����ᣬ��һ���������ᣩ���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�_____________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ�����͵����ǽ������ϣ���ҵ�Ͽ�ͨ�����·�Ӧ�ϳɣ�Al2O3+N2+ 3C![]() 2AlN+3CO������˵������ȷ����
2AlN+3CO������˵������ȷ����
A. Al2O3�Ȳ���������Ҳ���ǻ�ԭ��
B. �������뻹ԭ�����ʵ�������1��3
C. AlN�ǻ�ԭ����
D. ÿ����1 mol AlN��2mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.1molL��1 NH4Cl��Һ����ȷ���ǣ�������
A.�����¶ȣ���ҺpH����
B.ͨ������HCl��c��NH4+����c��Cl����������
C.c��NH4+��+c��OH����=c��Cl����+c��H+��
D.c��Cl������c��H+����c��NH4+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â����ֽ©�����²����մ���������������ɳ�С�����֪��Al��Al2O3��Fe��Fe2O3���۵㡢�е����������
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1 535 | 1 462 |
�е�/�� | 2 467 | 2 980 | 2 750 | �� |
I����1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ������_____���������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���________����Ӧ�����ӷ���ʽΪ_____________________��
��3��ʵ�����ܽ��������������Լ��������˵��Լ���_________������ţ���
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
��ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų�,��ʱ��Һ�е�Ԫ�صĴ�����ʽֻ��NO3-��NH4+,��Ԫ�صĴ�����ʽΪFe3+,�ڷ�Ӧ���������Һ�У���μ���6molL��1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺

��1�������⣬��д���������������ϡ�����ᷴӦ�����ӷ���ʽ��___________��
��2����CD�Σ����������ʵ������٣���˽η�����Ӧ�����ӷ���ʽΪ________________��
��3������������Ԫ�ص����ʵ���Ϊ_______mol��
��4��B���Ӧ�ij��������ʵ���Ϊ____mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com