
分析 (1)依据制备硫酸亚铁是铁和硫酸反应生成写出化学方程式;
(2)水浴加热是温度低于100°C时的加热条件,温度易于控制;
(3)铁粉可与铁离子反应生成亚铁离子,所以铁粉过量可以防止亚铁离子被氧化;
(4)实验中要得到硫酸亚铁溶液而除去固体杂质,所以热溶液过滤减少硫酸亚铁晶体析出而产生损失;
(5)亚铁离子容易被空气中的氧气氧化,所以实验中不能接触空气;
解答 (1)取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)水浴加热是温度低于100°C时的加热条件,温度易于控制;
故答案为:容易控制温度;
(3)铁粉过量是防止亚铁离子被氧化,铁和铁离子反应重新生成亚铁离子,反应的离子方程式为:Fe+2Fe3+═3Fe2+;
故答案为:Fe+2Fe3+═3Fe2+;
(4)热溶液过滤减少硫酸亚铁晶体析出,
故答案为:减小FeSO4的损失;
(5)Fe2+具有强氧化性,塞紧试管口的目的防止空气中的氧气进入试管氧化亚铁离子,
故答案为:防止空气进入试管将Fe2+氧化为Fe3+.
点评 本题考查了硫酸亚铁制备实验方法的分析判断,题目难度中等,注意保护Fe2+不被氧化是制取成功的关键.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液一定比弱电解质溶液导电能力强 | |
| B. | BaSO4是弱电解质 | |
| C. | 蔗糖、CO2是非电解质 | |
| D. | 盐酸能导电,所以盐酸是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1min内的平均反应速率v(N2O4)为0.060mol•L-1•min-1 | |
| B. | 若容器的体积为1L,则反应经0.5min后容器内n(NO2)为0.060mol | |
| C. | 反应达到平衡前,2v(N2O4)=v(NO2) | |
| D. | 反应达到平衡时,2v(N2O4)=v(NO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
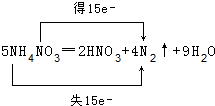
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由$\stackrel{-1}{Cl}$转移$\stackrel{+5}{Cl}$,共6e- | B. | 由$\stackrel{-1}{Cl}$转移$\stackrel{+5}{Cl}$,共5e- | ||
| C. | 由$\stackrel{0}{Cl}$转移$\stackrel{+5}{Cl}$,共6e- | D. | 由$\stackrel{0}{Cl}$转移$\stackrel{+5}{Cl}$,共5e- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com