
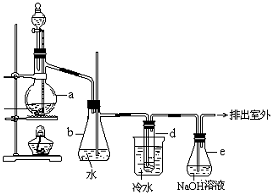
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,其中锥形瓶b是安全瓶,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;分析 (1)浓硫酸与蒸馏水混合过程中会放出大量热,浓硫酸密度大于水,应该先稀释浓硫酸、冷却后再加入乙醇、溴化钠;
(2)烧瓶中发生的反应有:溴化钠与硫酸反应生成硫酸氢钠和溴化氢、乙醇与溴化氢反应生成溴乙烷和水,据此写出反应的化学方程式;
(3)已知溴乙烷的沸点为38.4°C,冷水可以将溴乙烷蒸气变成液态溴乙烷;根据溴乙烷不溶于水、密度大于水进行分析;
(4)根据溴乙烷和溴的性质,逐一分析能够和溴化氢反应且不能和溴乙烷反应试剂,注意除杂不能引进新的杂质;
(5)反应剩余的溴化氢、反应副产物溴等有毒,能够污染大气,需要进行尾气吸收.
解答 解:(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,浓硫酸密度大于水,与蒸馏水混合时会放出大量热,所以混合时应该先加入蒸馏水,再加入浓硫酸,然后加入乙醇和溴化钠,
故答案为:蒸馏水、浓硫酸、乙醇、溴化钠;
(2)根据加入的反应物可知,烧瓶中发生的反应为:①溴化钠与硫酸反应生成硫酸氢钠和溴化氢,反应的方程式为:NaBr+H2SO4=NaHSO4+HBr、②乙醇与溴化氢反应生成溴乙烷和水,反应的化学方程式为CH3CH2OH+HBr→CH3CH2Br+H2O,
故答案为:NaBr+H2SO4=NaHSO4+HBr;CH3CH2OH+HBr→CH3CH2Br+H2O;
(3)溴乙烷的沸点为38.4°C,通过冷水可以冷却溴乙烷,将溴乙烷由气态变成液态;由于溴乙烷不溶于水,所以冷却后混合液体会分层,溴乙烷密度大于水,在混合液的下层有油状液体,故答案为:冷却溴乙烷由气态转变为液态;分层,下层为油状液体;
(4)A.NaI和溴单质反应,但生成的碘单质会混入,故A错误;
B.溴单质和氢氧化钠反应,溴代烷也和NaOH溶液中水解反应,故B错误;
C.溴单质和Na2SO3溶液发生氧化还原反应,可以除去溴单质,故C正确;
D.KCl和溴单质不反应,不能除去溴单质,故D错误;故答案为:C;
(5)该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染,
故答案为:吸收HBr等气体,防止大气污染.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,明确物质的性质及实验原理是设计实验的前提,同时考查了学生分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
| 化学式 | 被区分的物质(名称) | 理由 |
| Na2CO3、CaCO3、NaCl | NaCl | 由两种元素组成,或不含碳(或氧)元素 |
| C、CO2、H2CO3 | 碳 | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 德国化学家维勒用氰酸铵合成了尿素,打破了有机物与无机物的界限 | |
| B. | 根据核磁共振谱的分析能得到有机物的相对分子质量 | |
| C. | 分析红外光谱图可以初步判断有机物中具有哪些基团 | |
| D. | 同位素示踪法可以用来确定有机反应中化学键的断裂位置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y氧化物对应水化物 | |
| C. | X元素形成的单核阴离子还原性大于Y形成的单核阴离子 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能是单一气体,也可能存在原气体中的两种气体 | |
| B. | 可能含有也可能不含一氧化碳 | |
| C. | 无论顺序如何,各瓶增重相同 | |
| D. | 成分和洗气瓶的排列顺序无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可溶性铁盐或铝盐可用于水的净化 | |
| B. | 电解MgCl2溶液可制金属镁 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑥ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com