
| A�� | �μ�KI��Һʱ��ת��2 mol e-ʱ���� 1 mol��ɫ���� | |
| B�� | ͨ��SO2����Һ�����ɫ�������� SO2��Ư���� | |
| C�� | ͨ��SO2ʱ��SO2��I2��Ӧ��I2����ԭ�� | |
| D�� | ����ʵ�������£����ʵ������ԣ�Cu2+��I2��SO2 |
���� ��CuSO4��Һ����μ�KI��Һ���������۲쵽������ɫ����CuI������2Cu2++4I-=2CuI��+I2������Ӧ��Ļ�����в���ͨ��SO2���壬��Һ�����ɫ������SO2+I2+2H2O=2HI+H2SO4�����������ԭ��Ӧ�����
��� �⣺A���μ�KI��Һʱ����ӦΪ2Cu2++4I-=2CuI��+I2��ת��2mol e-ʱ����2mol��ɫ��������A����
B��ͨ��SO2����Һ�����ɫ��SO2+I2+2H2O=2HI+H2SO4��������SO2�Ļ�ԭ�ԣ���B����
C��ͨ��SO2ʱ��S02��I2��Ӧ��SO2+I2+2H2O=2HI+H2SO4��I2������������C����
D���ɷ�Ӧ2Cu2++4I-=2CuI��+I2��SO2+I2+2H2O=2HI+H2SO4������������ԭ��Ӧ���������������Դ������������֪��������ΪCu2+��I2��SO2����D��ȷ��
��ѡD��
���� ���⿼�����ʵ����ʼ�������ԭ��Ӧ��Ϊ��Ƶ���㣬���շ�����������ԭ��ӦΪ���Ĺؼ���ע��������Ϣ�жϷ����ķ�Ӧ����Ӧ��Ԫ�صĻ��ϼ۱仯��ע�ػ���֪ʶ�Ŀ��飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2Na2O2+2H2O=4NaOH+O2�� | B�� | 2F2+2H2O=4HF+O2 | ||
| C�� | 3NO2+H2O=NO+2HNO3 | D�� | 3Fe+4H2O��g��$\frac{\underline{\;\;��\;\;}}{\;}$4H2+Fe3O4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ���� | 1 | 2 | 3 | 4 |
| V��Na2S2O3����mL�� | 28.32 | 25.31 | 25.30 | 25.32 |
| ��ʼ������pH | ������ȫ��pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 1.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
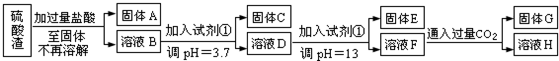
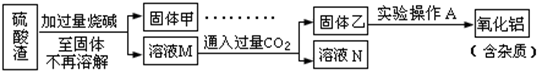
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
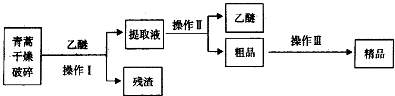
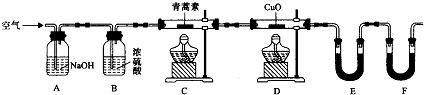
| װ�� | ʵ��ǰ/g | �����/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
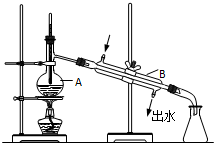 ��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش��������⣮
��ͼΪʵ������ȡ����ˮ��װ��ʾ��ͼ������ͼʾ�ش��������⣮�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com