


分析 (1)硼原子核外电子数目为5,根据核外电子排布规律书写电子排布式;氮的价电子数为5,据此画价电子排布图;
(2)价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果,先判断价层电子对数,再确定构型和杂化方式;价层电子对互斥理论判断其σ电子对和孤电子对数目;
(3)由图及元素守恒可写出由B2O3制备BF3的方程式;
(4)根据其结构与石墨相似,层与层之间应该靠分子间作用力结合;金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,所以金刚石的一个晶胞中含有的碳原子数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为 $\frac{25g}{{N}_{A}}$,一个立方氮化硼晶胞的体积是(361.5pm)3,根据$ρ=\frac{m}{V}$计算密度;因此立方氮化硼的密度是 $\frac{25×4}{(361.5×10{\;}^{-10}){\;}^{3}{N}_{A}}$g•cm-3.
解答 解:(1)硼原子核外电子数目为5,原子的电子排布式为1s22s22p1,氮的价电子数为5,价电子排布图为 ,
,
故答案为:1s22s22p1; ;
;
(2)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3分子的中心原子B原子的价层电子对数为3,属于sp2杂化;BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对为4,该离子中不含孤电子对,为正四面体结构,
故答案为:120°;sp2杂化;正四面体;
(3)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,方程式为B2O3+3CaF2+3H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O,
故答案为:B2O3+3CaF2+3H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$2BF3↑+3CaSO4+3H2O;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,层间作用力为范德华力,根据金刚石的结构可以判断出金刚石的一个晶胞中含有的碳原子数=8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为 $\frac{25g}{{N}_{A}}$,一个立方氮化硼晶胞的体积是(361.5pm)3,因此立方氮化硼的密度是 $\frac{25×4}{(361.5×10{\;}^{-10}){\;}^{3}{N}_{A}}$g•cm-3=3.52g•cm-3,
故答案为:范德华力; $\frac{25×4}{(361.5×10{\;}^{-10}){\;}^{3}{N}_{A}}$g•cm-3;3.52.
点评 本题考查较为全面,涉及到化学方程式的书写、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 白磷在空气中加热到一定温度能转化为红磷 | |
| D. | 过量的铜与稀硝酸反应有一氧化氮生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷分子中三个碳原子在一条直线上 | |
| B. | 符合通式CnH2n+2的均属于烷烃 | |
| C. | 丙烷的二氯代物有5种 | |
| D. | 丁烷能与氯气在光照时发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙烯与乙醇的混合物在氧气中充分燃烧,消耗氧气的分子数为一定为3NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 0.1mol乙烷分子中含有的共价键数目为0.7NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
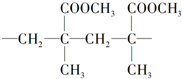 ,其单体不可能具有的化学性质是( )
,其单体不可能具有的化学性质是( )| A. | 能使酸性KMnO4溶液褪色 | B. | 与NaOH溶液共热可生成一种钠盐 | ||
| C. | 能催化加氢生成2甲基丙酸甲酯 | D. | 能发生缩聚反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com