
分析 在Cu、Zn和稀硫酸组成的原电池中,锌失电子变成离子进入溶液,发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+,正极上是氢离子得电子生成氢气,金属铜是正极,电极反应为:2H++2e-=H2↑,电池反应为:Zn+2H+=H2↑+Zn2+,可以根据电子守恒思想来计算.
解答 解:(1)在Cu、Zn和稀硫酸组成的原电池中,锌失电子变成离子进入溶液,发生氧化反应,是负极,电极反应式为Zn-2e-=Zn2+,正极上是氢离子得电子生成氢气,金属铜是正极,电极反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)根据铜电极上的反应:2H++2e-=H2↑,产生2g气体的过程中有2mol的电子转移,所以产生12g气体的过程中有12mol电子转移,故答案为:12.
点评 本题考查原电池的设计和工作原理,题目难度不大,注意把握原电池的组成和原理,注重基础知识的积累.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
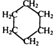 可用键线式表示为
可用键线式表示为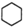 ,
,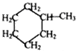 可用键线式表示为
可用键线式表示为 ;
;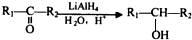 ;
;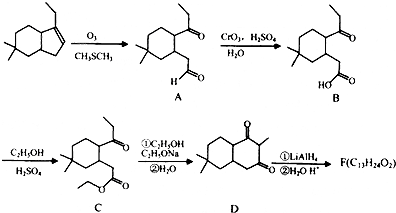
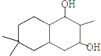 ;
; ;
;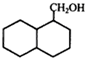 结构
结构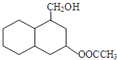 .
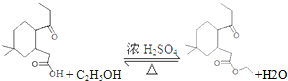
.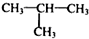 制
制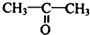 的流程图并注明反应条件.
的流程图并注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸是SO2与水反应的产物,显酸性 | |
| B. | SO2溶于水,剧烈反应生成亚硫酸 | |
| C. | 亚硫酸具有漂白性,能够使品红溶液褪色 | |
| D. | 亚硫酸不稳定,容易分解为水和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH只适用于稀溶液,对于c(H+)>1 mol/L时,一般不用pH而直接用H+的浓度表示 | |
| B. | 水的电离、弱酸、弱碱的电离及盐类水解都是吸热的 | |
| C. | pH每增加一个单位,c(H+) 则减少10倍 | |
| D. | 25℃纯水中加入盐酸后,pH<7,此时水的离子积常数KW≠1×10-14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com