


 也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式
也能发生类似V→Ⅵ的反应,请写出所生成醇的结构简式 ,则甲苯中甲基上的H原子被氯原子取代生成Ⅳ;
,则甲苯中甲基上的H原子被氯原子取代生成Ⅳ; 与水;
与水; 也能发生类似V→Ⅵ的反应,先发生类似加成反应得到中间产物,CH3CH2-连接醛基中的碳原子、-MgBr连接醛基中的O原子,然后发生水解反应,-OMgBr转化为-OH.
也能发生类似V→Ⅵ的反应,先发生类似加成反应得到中间产物,CH3CH2-连接醛基中的碳原子、-MgBr连接醛基中的O原子,然后发生水解反应,-OMgBr转化为-OH.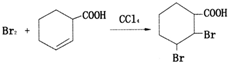 ,
, ;
; ,则甲苯中甲基上的H原子被氯原子取代生成Ⅳ,所以反应类型为取代反应,
,则甲苯中甲基上的H原子被氯原子取代生成Ⅳ,所以反应类型为取代反应, ;取代反应;
;取代反应; 与水,则反应方程式为
与水,则反应方程式为 ,故答案为:
,故答案为: ;
; 、
、 、
、 ,故答案为:
,故答案为: ;
; ;
; ;
; 也能发生类似V→Ⅵ的反应,先发生类似加成反应得到中间产物,CH3CH2-连接醛基中的碳原子、-MgBr连接醛基中的O原子,然后发生水解反应,-OMgBr转化为-OH,则生成醇的结构简式为
也能发生类似V→Ⅵ的反应,先发生类似加成反应得到中间产物,CH3CH2-连接醛基中的碳原子、-MgBr连接醛基中的O原子,然后发生水解反应,-OMgBr转化为-OH,则生成醇的结构简式为 ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
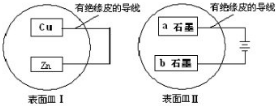
| A、表面皿Ⅰ和表面皿Ⅱ中溶液pH不断升高 |
| B、锌片和石墨a均发生氧化反应.铜片和石墨a上均有H2放出 |
| C、表面皿Ⅰ溶液中c(Zn2+)浓度增大 |
| D、石墨b附近滴加酚酞变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
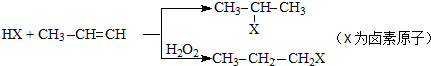
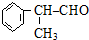 ,该物质是一种香料.
,该物质是一种香料.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前对碱式滴定管仰视读数,滴定后又俯视,会使测定结果偏高 |
| B、滴定管和锥形瓶使用之前均需用所装溶液润洗 |
| C、用酚酞做指示剂,滴定终点是当最后一滴NaOH溶液滴入时,溶液颜色由无色变为浅红色,且半分钟内不变色 |
| D、滴定前锥形瓶内含有少量水对实验结果无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
| +6 |
| Cr |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入的酸过量 |
| B、生成的盐不水解 |
| C、酸和碱等物质的量混合 |
| D、反应后溶液中c(A-)=c(M+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当调节溶液的pH至3.7时,Fe3+才能完全沉淀 |
| B、当c(OH-)达到10-9时,Cu2+开始沉淀,此时Fe3+尚未沉淀完全 |
| C、原溶液中,c(SO42-):[c(Cu2+)+c(Fe3+)]=4:3 |
| D、若要除去上述混合溶液中的Fe3+,加入NaOH固体比加入Cu(OH)2效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cu2+、Cl-、SO42- |
| B、Na+、H+、NO3-、CO32- |
| C、Na+、H+、OH-、SO42- |
| D、Ba2+、Cu2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com