
| A.容量瓶中原有少量蒸馏水 | B.定容时俯视刻度线 |
| C.有少量NaOH溶液残留在烧杯里 | D.称量时误操作为“左码右物” |
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为了加快过滤速率,可用玻璃棒不断搅拌过滤器中的液体 |
| B.可用激光笔鉴别KI溶液和淀粉溶液 |
| C.可用pH试纸测定新制的氯水的pH |
| D.可用玻璃棒蘸取少量待测物质的浓溶液做焰色反应实验 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.向待检液中加入BaCl 2溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定含有SO42- 2溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定含有SO42- |
| B.向待检液中加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ |
| C.向待检液中加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定含有大量的CO32- |
| D.向待检液中加入加入几滴氯水,再加入KSCN溶液,溶液立即变红,则原溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 色变成____________色。
色变成____________色。| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
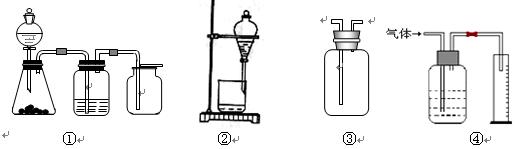
| A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸 |
| B.装置②可用于CCl4萃取碘水中的碘并分液 |
| C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等 |
| D.装置④能用于测量气体体积的装置 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
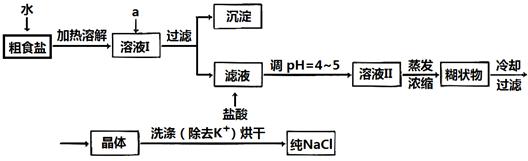
 器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。
器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。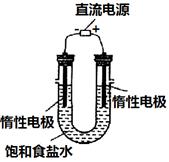
 MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。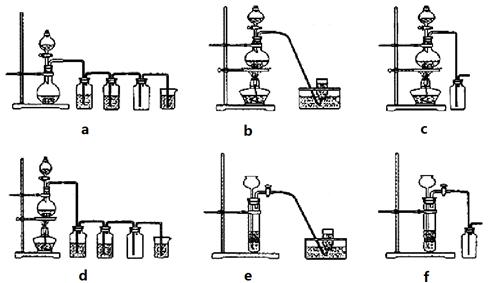
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com