
| A. | 含有大量HCO3-的溶液中:NH4+、Na+、AlO2-、Cl- | |
| B. | PH=13的溶液中:Cl-、CO32-、K+、Na+ | |
| C. | 水电离c(OH-)=10-10mol/L的溶液中:NH4+、Na+、I-、Cl- | |
| D. | 能使甲基橙显红色的溶液中:Fe2+、K+、Cr2O72-、SO42- |
分析 A.与HCO3-反应的离子不能大量共存;
B.PH=13的溶液呈碱性;
C.水电离c(OH-)=10-10mol/L的溶液可能呈酸性或碱性;
D.能使甲基橙显红色的溶液呈酸性.
解答 解:A.AlO2-与HCO3-发生反应生成氢氧化铝沉淀和碳酸根离子而不能大量共存,故A错误;
B.PH=13的溶液呈碱性,离子之间不发生任何反应,可大量共存,故B正确;
C.水电离c(OH-)=10-10mol/L的溶液可能呈酸性或碱性,碱性条件下NH4+不能大量共存,故C错误;
D.能使甲基橙显红色的溶液呈酸性,酸性条件下Fe2+、Cr2O72-发生氧化还原反应而不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存及分析与应用能力的综合考查,题目难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 敞口久置,二者浓度均会变小 | B. | 常温下,均会使铝、铁钝化 | ||
| C. | 敞口久置,二者质量均会变大 | D. | 均具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焦炭炼铁、发酵粉烘焙糕点均会产生温室气体 | |
| B. | 浓硫酸滴在白纸上,白纸变黑,体现了浓硫酸的吸水性 | |
| C. | Cu与H2SO4在加热条件下发生反应,体现了浓H2SO4的还原性 | |
| D. | 雨水样品在空气中放置2小时后,测得pH变小,因为样品吸收了空气中的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2=2H++2e- | B. | H2+2OH--2e-═2H2O | ||
| C. | O2+2H2O+4e-═4OH- | D. | 4H++O2═2H2O-4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:K+、Cu2+、NO3-、Cl- | |
| B. | 0.1 mol•L-1CaCl2溶液中:Mg2+、NH4+、CO32-、SO42- | |
| C. | pH=12的溶液:Na+、K+、SiO32-、Cl- | |
| D. | 使甲基橙变红的溶液中:Na+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0-2min的平均速率v(X)=0.01mol/(L•min) | |
| B. | 平衡时Y的转化率为0.5 | |
| C. | 其它条件不变,升温,平衡逆向移动 | |
| D. | 其它条件不变,增加X的浓度,v正增大,v逆减少,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色的溶液中:Fe3+、K+、ClO-、Cl- | |
| B. | pH=12的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量Mg2+的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | c(H+)=0.1mol•L-1的溶液中:K+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
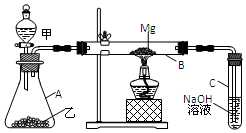 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性.用如图所示装置进行Mg和SO2反应的实验.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性.用如图所示装置进行Mg和SO2反应的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com