
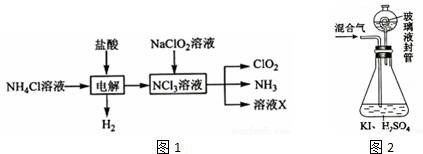
分析 (1)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3;
(2)由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)①玻璃液封装置可防止有害气体逸出;
②淀粉遇碘单质变蓝;
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2);
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),则生成的碘单质偏高,测定混合气中ClO2的质量就偏高,据此分析.
解答 解:(1)由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,则阳极反应方程式为NH4++3Cl--6e-═NCl3+4H+,
故答案为:NH4++3Cl--6e-═NCl3+4H+;
(2)a.ClO2易溶于水,不能利用水吸收氨,故a错误;
b.浓硫酸可以吸收氨气,且不影响ClO2,故b正确;
c.碱石灰不能吸收氨气,故c错误;
d.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故d错误;
故答案为:b;
(3)①玻璃液封装置的作用是吸收残留的ClO2气体(避免碘的逸出),故答案为:吸收残留的ClO2气体(避免碘的逸出);
②V中加入的指示剂通常为淀粉溶液,滴定至终点的现象是溶液由蓝色变为无色,且半分钟内不变色,故答案为:淀粉溶液;溶液由蓝色变为无色,且半分钟内不变色;
③含有Na2S2O3物质的量为0.02 L×0.2mol/L=0.004 mol,则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.004mol
所以n(ClO2)=0.0008mol,所以m(ClO2)=0.008 mol×67.5g/mol=0.05400g,
故答案为:0.05400;
④根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),则生成的碘单质偏高,测定混合气中ClO2的质量就偏高,又空气中的氧气会将KI氧化成碘单质导致碘单质偏高,离子方程式为:4I-+O2+4H+═2I2+2H2O,故答案为:4I-+O2+4H+═2I2+2H2O.
点评 本题考查较为综合,涉及物质含量的测定以及分离等知识,为高频考点,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 降低温度 | C. | 更换催化剂 | D. | 减小CO的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -441 kJ/mol | B. | +441 kJ/mol | C. | -882 kJ/mol | D. | +882 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com