
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 锌片插入硝酸银溶液中Zn+Ag+═Zn2++Ag | |
| C. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| D. | 硫酸镁溶液和氢氧化钡溶液反应 SO42-+Ba2+═BaSO4↓ |
分析 A.醋酸在离子反应中保留化学式;
B.电子、电荷不守恒;
C.反应生成碳酸氢铵;
D.漏写生成氢氧化镁的离子反应.
解答 解:A.碳酸钙溶于醋酸的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故A错误;
B.锌片插入硝酸银溶液中的离子反应为Zn+2Ag+═Zn2++2Ag,故B错误;
C.在稀氨水中通入过量CO2的离子反应为NH3•H2O+CO2═NH4++HCO3-,故C正确;
D.硫酸镁溶液和氢氧化钡溶液反应的离子反应为2OH-+Mg2++SO42-+Ba2+═BaSO4↓+Mg(OH)2↓,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应进行的越快,化学反应现象越明显 | |
| B. | 某反应中,经2min后B浓度减少0.6mol•L-1,在2min时用B表示的反应速率为0.6mol•L-1•min | |
| C. | 化学反应中的能量变化都是化学能转化成热能 | |
| D. | 原电池的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④⑥ | C. | ①②④⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
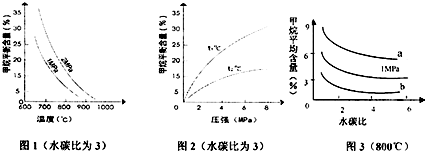
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的性质与用途: 磺胺类药物能抑制细菌合成核酸--治疗肺炎、脑膜炎、尿路感染、呼吸道感染 酸能与碱中和-----胃酸过多的病人服用含氢氧化镁的药物 | |
| B. | 保护环境: 控制“白色污染”--禁止使用所有塑料制品 防止水的污染--提倡使用无磷洗衣粉 | |
| C. | 基本安全常识: 饮用假酒中毒--由甲醇引起 食用假盐中毒--由亚硝酸钠引起 | |
| D. | 生活中的一些做法: 除去衣服上的油污--可用汽油洗涤 使煤燃烧更旺--可增大煤与空气接触面积 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
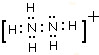 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com