
硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题。
(1)ag铜与bmL浓HNO3充分反应后得到V1 L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2 L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子。)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量。
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐。
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度
① ,②NO2: (3V1-3V2)/44.8
NO: (3V2-V1)/44.8(各2分)
,②NO2: (3V1-3V2)/44.8
NO: (3V2-V1)/44.8(各2分)
(2) ① 3Cu+Cu(NO3)2+4H2SO4 ==4CuSO4+2NO↑+4H2O;
② 4:3; 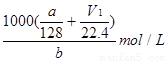
【解析】
试题分析:解:浓硝酸与铜反应生产了二氧化氮和硝酸铜和水,硝酸中氮元素被还原为二氧化氮和一氧化氮,所以生成X气体时被还原的氮元素的克数为:
②由题可以知道,铜剩余,所以在反应过程中硝酸的浓度越来越稀,所以反应的产物为二氧化氮和一氧化氮的混合物,设二氧化氮的体积为a,则一氧化氮为V1 –a,
而二氧化氮与水的反应为:
3NO2+H2O=2HNO3+NO
3 1
a b
3/1=a/b,b=1/3a,所以V1 –a+1/3a=V2 ,故a= (3V1-3V2)/2,
即NO2的物质的量为:(3V1-3V2)/44.8mol
NO的物质的量为:(3V2-V1)/44.8mol
(2) ① 该反应为:3Cu+Cu(NO3)2+4H2SO4 ==4CuSO4+2NO↑+4H2O;
②因为溶液中只剩下一种盐,硝酸铜恰好与铜完全反应,
故原来的a:c=(3+1):3=4:3;
硝酸跟的物质的量n=a/128
根据物料守恒可以知道硝酸的物质的量为N元素的物质的量,
故硝酸的物质的量n=(3V1-3V2)/44.8+(3V2-V1)/44.8+a/128=(V1/22.4+a/128)mol;
所以浓硝酸的浓度c=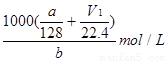 。
。
考点:硝酸与金属反应
点评:本题考查了硝酸与金属的反应的计算,该计算题有一定的技巧性,难度比较大。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题。
(1)ag铜与bmL浓HNO3充分反应后得到V1 L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2 L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子。)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量。
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐。
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省江都市甘棠中学高二下学期期末考试化学试卷(带解析) 题型:计算题
硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题。
(1)ag铜与bmL浓HNO3充分反应后得到V1 L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2 L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子。)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量。
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐。
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度
查看答案和解析>>
科目:高中化学 来源:2010—2011学年浙江省杭州二中高一下学期期中考试化学试卷 题型:计算题
硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题。
(1)ag铜与bmL浓HNO3充分反应后得到V1 L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2 L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子。)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量。
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐。
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com