
| A. | 等于10s | B. | 等于5 s | C. | 大于10 s | D. | 小于10 s |
分析 先计算反应物N2O4的浓度由0.1mol/L降到0.07mol/L时的平均反应速率,再假设以相同的反应速率计算反应物N2O4的浓度由0.07mol/L降到0.04mol/L所需反应时间,由于随反应进行反应速率降低,实际上反应所需时间比这个时间长,据此分析解答.
解答 解:反应物N2O4的浓度由0.1mol/L降到0.07mol/L时的平均反应速率=$\frac{0.1mol/L-0.07mol/L}{10s}$=0.003mol/(L.s),假设以0.003mol/(L.s)的反应速率计算反应物A的浓度由0.07mol/L降到0.04mol/L所需反应时间=$\frac{0.07mol/L-0.04mol/L}{0.003mol/(L•s)}$=10s,实际上A物质的化学反应速率是随着物质浓度的减小而减小,所以反应物N2O4的浓度由0.07mol/L降到0.04mol/L时的平均反应速率小于0.003mol/(L.s),所以所用时间应大于10s,
故选C.
点评 本题考查了化学反应速率的有关计算,难度不大,明确化学反应速率是平均值不是瞬时值,化学反应速率随浓度的变化而变化.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
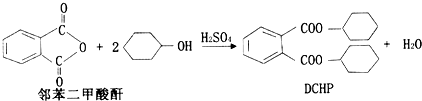
| A. | DCHP的分子式为C20H28O4 | |
| B. | 上述制备DCHP的反应属于取代反应 | |
| C. | DCHP苯环上的一氯代物有4种 | |
| D. | 1molDCHP最多可与含4molNaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 能使潮湿的有色布条褪色 | |
| B. | 钠在氯气中燃烧,生成白色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
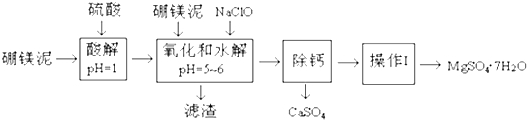
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
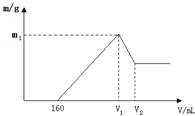 将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL2mol/L硫酸溶液中,然后再滴加1mol/L氢氧化钠溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫酸酸化高锰酸钾溶液,能起到增强氧化性作用 | |
| B. | 向某溶液中加入稀NaOH溶液未能产生使湿润的红色石蕊试变蓝的气体,说明原溶液中不含NH4+ | |
| C. | 在坩埚中加热MgCl2•6H2O晶体可以得到无水MgCl2 | |
| D. | 向某溶液中加入稀盐酸能产生使品红溶液褪色的气体,说明原溶液中一定含有SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①④②⑤ | B. | ③①⑤④② | C. | ③②①⑤④ | D. | ⑤②④①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com