
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | 元素R的氧化物对应水化物一定为强酸 | |
| C. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |
分析 短周期元素,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,同一周期元素,原子半径随着原子序数增大而减小,同一主族元素,原子半径随着原子序数增大而增大,根据图中数据知,X和Q属于第IVA族元素、Z和T属于第VA族元素、Y属于第VIA族元素、R属于第VIIA族元素,R有正化合价所以为Cl元素,X半径小于Q,所以X为C元素、Q为Si元素;X原子半径大于Y,所以Y为O元素;Z的原子半径小于T,所以Z为N元素、T为P元素;再结合题目分析解答.
解答 解:X和Q属于第IVA族元素、Z和T属于第VA族元素、Y属于第VIA族元素、R属于第VIIA族元素,R有正化合价所以为Cl元素,X半径小于Q,所以X为C元素、Q为Si元素;X原子半径大于Y,所以Y为O元素;Z的原子半径小于T,所以Z为N元素、T为P元素,
A.X与Y可以形成阴离子CO32-,故A正确;
B.R为Cl元素,其含氧酸HClO为弱酸,故B错误;
C.Z为N元素、T为P元素,N的氢化物中含有氢键、P的氢化物中不含氢键,氢键的存在导致氨气熔沸点高于PH3,故C正确;
D.由C形成的化合物SiC和CCl4,SiC和CCl4晶体类型分别为原子晶体、分子晶体,所以其晶体类型不同,故D正确;
故选B.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,明确元素化合价与族序数的关系、物质的结构和性质为解答关键,注意Cl元素的含氧酸不一定都是强酸,为易错点,试题培养了学生的分析能力及灵活应用能力.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | 元素的性质呈周期性变化的根本原因是核外电子排布呈周期性变化 | |
| C. | 第IA族元素与第VIIA族元素形成的化合物都是离子化合物 | |
| D. | 元素周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇的沸点高于乙醛是因为乙醇分子间存在氢键,而乙醛分子间只有范德华力 | |
| B. | 单质碘易溶于CCl4而微溶于水,是因为I2和CCl4都是非极性分子而水是极性分子 | |
| C. | NH3与CH4的空间构型不同是因为NH3中存在孤电子对而CH4中只有成键电子对 | |
| D. | 水分子比硫化氢稳定是因为水分子存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3 v (N2)=v(H2) | B. | v (N2)=3v(H2) | C. | 1.5v (H2)=v(NH3) | D. | v (N2)=2v(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | Ba(OH)2溶液与稀硫酸反应:Ba2++OHˉ+H++SO42-═BaSO4↓+H2O | |
| C. | CaCO3中加入稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | Mg(OH)2与盐酸反应:OHˉ+2H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
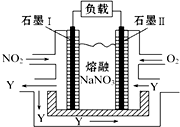 NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨Ⅰ为电池的负极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-═N2O5.
NO2、O2和熔融NaNO3可制作燃料电池,其原理见图,石墨Ⅰ为电池的负极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为NO2-e-+NO3-═N2O5.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com