
 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:| C(H2)C(CO) |
| C(H2O) |
| t/K | 300 | 400 | 500 | … |
| K/(mol?L-1)2 | 4×106 | 8×107 | K1 | … |
| 4×4 |
| 4×23 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
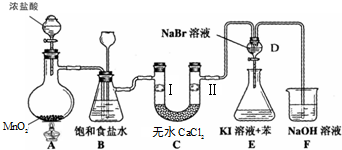
查看答案和解析>>
科目:高中化学 来源: 题型:
A、稀释Na2CO3溶液时,
| ||||||
B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||||
| C、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | ||||||
| D、常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
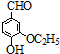 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.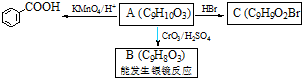
| CrO3/H2SO4 |
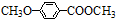 )是一种医药中间体.请设计合理方案用茴香醛(
)是一种医药中间体.请设计合理方案用茴香醛(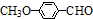 )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).例如:
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).例如:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
| A | 苯 | 苯酚 | 溴水 | 分液 |
| B | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| C | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| D | 甲醛 | 甲酸 | 稀氢氧化钠溶液 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com