
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
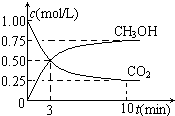
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.分析 (1)①在体积恒为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下合成甲醇,测得CO2和CH3OH(g)的浓度随时间变化如图所示.达到平衡时生成甲醇0.75mol/L×1L=0.75mol,放出热量150kJ,生成1mol甲醇放热=$\frac{150KJ}{0.75mol}×1mol$=200KJ,标注物质聚集状态和对应反应焓变写出热化学方程式;
②由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,根据v=$\frac{△c}{△t}$计算v(H2);
③化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
④根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
⑤能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量;
(2)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;根据△G的大小判断反应能否进行.
解答 解:(1)①在体积恒为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下合成甲醇,测得CO2和CH3OH(g)的浓度随时间变化如图所示.达到平衡时生成甲醇0.75mol/L×1L=0.75mol,放出热量150kJ,生成1mol甲醇放热=$\frac{150KJ}{0.75mol}×1mol$=200KJ,热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-200kJ/mol,
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-200kJ/mol;
②由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=$\frac{2.25mol}{10min}$=0.225mol/(L•min),故答案为:0.225mol/(L•min);
③反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
④a.2个O-H键断裂的同时,有3个H-H键断裂,说明3mol氢气消耗同时1mol水消耗,正逆反应速率相同,反应达到平衡状态,故a正确;
b.反应前后气体质量不变,气体物质的量变化,当混合气体平均相对分子质量不再改变,说明反应达到平衡状态,故b正确;
c.反应速率之比等于化学方程式计量数之比,为正反应速率之比,正反应速率v(H2)=0.6mol/(L•min),逆反应速率v(CO2)=0.2mol/(L•min),说明二氧化碳的正逆反应速率相同,反应达到平衡状态,故c正确;
d.反应前后气体质量和体积不变,密度始终保持不变,不能说明反应达到平衡状态,故d错误;
故答案为:a、b、c;
⑤能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,使平衡向正反应移动,则.
A.该反应正反应是放热反应,升高温度平衡向逆反应移动,比值减小,故A错误;
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,比值不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应移动,比值增大,故C正确;
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,比值增大,故D正确;
故答案为:CD;
(2)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T•△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行;
故答案为:2CO2+4e-+2H2O=2CO+4OH-;不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
点评 本题考查反应速率计算、化学平衡的影响因素、平衡常数等,题目难度中等,注意基础知识的掌握,把握图象的分析是解答的关键.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 醛基的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 尿素[CO(NH2)2]是一种有机物 | D. | 聚丙烯的化学式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,分别体现了它的漂白性和还原性 | |
| B. | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,说明Fe(NO3)2样品已经变质 | |
| C. | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加盐酸,沉淀不溶解,说明该溶液中一定存在SO42- | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(正)增大,v(逆)减小 | B. | v(正)减小,v(逆)增大 | ||
| C. | v(正)、v(逆)不同程度增大 | D. | v(正)、v(逆)同等程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
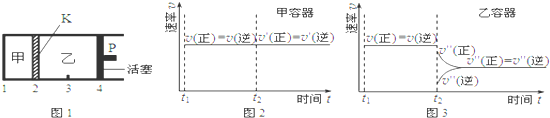
| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
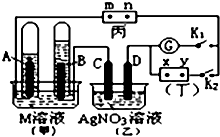 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com