
”¾ĢāÄæ”æ¼×ĶéŹĒŅ»ÖÖĒå½ąÄÜŌ“£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.Ņ»¶ØĪĀ¶ČĻĀ£¬·“Ó¦CO2(g)+4H2(g)=CH4(g)+2H2O(g)ÄÜ×Ō·¢½ųŠŠ£¬øĆ·“Ó¦µÄ¦¤H£¾0
B.¼īŠŌ¼×Ķé-æÕĘųČ¼ĮĻµē³ŲµÄøŗ¼«·“Ó¦ĪŖCH4-8e-+10OH-=CO![]() +7H2O
+7H2O
C.±ź×¼×“æöĻĀ£¬5.6LCH4ŌŚæÕĘųÖŠĶźČ«Č¼ÉÕ£¬×ŖŅʵē×ӵďżÄæŌ¼ĪŖ2.408”Į1024
D.¼×ĶéŗĶĪ¢ÉśĪļ¹²Ķ¬×÷ÓĆæÉŅŌŹµĻÖ³ĒŹŠ·ĻĖ®ĶѵŖ“¦Ąķ£¬·“Ó¦ĪĀ¶ČŌ½øߣ¬ĶѵŖĖŁĀŹŌ½æģ
”¾“š°ø”æB
”¾½āĪö”æ
A£®øĆ·“Ó¦ÖŠ”÷S£¼0£¬·“Ó¦ÄÜ×Ō·¢½ųŠŠ£¬Ōņ”÷G=”÷H-T”÷S£¼0£¬Ōņ”÷H£¼0£¬¹ŹA“ķĪó£»
B£®ĶØČė¼×ĶéµÄŅ»¶ĖĪŖµē³ŲµÄøŗ¼«£¬µē½āÖŹČÜŅŗĪŖ¼īŠŌČÜŅŗ£¬øŗ¼«µē¼«·“Ó¦Ź½ĪŖ£ŗCH4-8e-+10OH-=CO![]() +7H2O£¬¹ŹBÕżČ·£»
+7H2O£¬¹ŹBÕżČ·£»
C£®¼×ĶéĶźČ«Č¼ÉյĻÆѧ·½³ĢŹ½£ŗCH4+2O2![]() CO2+2H2O£¬1mol¼×ĶéĶźČ«Č¼ÉÕŹ±×ŖŅĘ8molµē×Ó£¬±ź×¼×“æöĻĀ£¬5.6LCH4¼×ĶéµÄĪļÖŹµÄĮæĪŖ
CO2+2H2O£¬1mol¼×ĶéĶźČ«Č¼ÉÕŹ±×ŖŅĘ8molµē×Ó£¬±ź×¼×“æöĻĀ£¬5.6LCH4¼×ĶéµÄĪļÖŹµÄĮæĪŖ![]() =0.25mol£¬Ōņ×ŖŅʵē×Ó2mol£¬ŹżÄæĪŖ1.204”Į1024£¬¹ŹC“ķĪó£»
=0.25mol£¬Ōņ×ŖŅʵē×Ó2mol£¬ŹżÄæĪŖ1.204”Į1024£¬¹ŹC“ķĪó£»
D£®øßĪĀĻĀĪ¢ÉśĪļ·¢Éś±äŠŌ£¬²»ĄūÓĆĶѵŖ£¬¹ŹD“ķĪó”£
“š°øŃ”B”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĶ¼ĖłŹ¾ĪŖ800”ꏱA”¢B”¢CČżÖÖĘųĢåŌŚĆܱÕČŻĘ÷ÖŠ·“Ó¦Ź±ÅØ¶ČµÄ±ä»Æ£¬Ö»“ÓĶ¼ÉĻ·ÖĪö²»ÄÜµĆ³öµÄ½įĀŪŹĒ(”” )
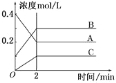
A£®AŹĒ·“Ó¦Īļ
B£®Ē°2 min AµÄ·Ö½āĖŁĀŹĪŖ0.1 mol”¤L£1”¤min£1
C£®Ē°2 min CµÄÉś³ÉĖŁĀŹĪŖ0.2 mol”¤L£1”¤min£1
D£®·“Ó¦µÄ·½³ĢŹ½ĪŖ£ŗ2A(g)![]() 2B(g)£«C(g)
2B(g)£«C(g)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æŗ¬ĮņĪļÖŹµÄŃ»·£¬ŹĒÄÜŌ“æŖ·¢ŗĶĄūÓƵÄÖŲŅŖĶ¾¾¶Ö®Ņ»”£
(1)ŃŠ¾æČĖŌ±ĄūÓĆŗ¬ĮņĪļÖŹČČ»Æѧѻ·ŹµĻÖĢ«ŃōÄܵÄ×Ŗ»ÆÓė“ę“¢£¬¹ż³ĢČēĻĀ£ŗ
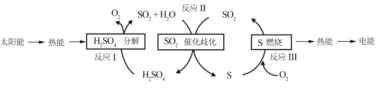
¢Ł·“Ó¦¢ń£ŗ2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ¦¤H1=+551 kJmol -1
·“Ó¦¢ó£ŗS(s)+O2(g) = SO2(g) ¦¤H3=£297 kJmol -1
·“Ó¦¢ņµÄČČ»Æѧ·½³ĢŹ½ĪŖ________”£
¢Ś¶ŌÓŚ·“Ó¦¢ņ£¬½«Ķ¶ĮĻ±Č£Øn(SO2):n(H2O)£©ĪŖ 3:2 µÄ»ģŗĻĘųĢå³äČėŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬ ŌŚ²»Ķ¬Ń¹ĒæĻĀ£¬H2SO4 ŌŚĘ½ŗāĢåĻµÖŠĪļÖŹµÄĮæ·ÖŹżĖęĪĀ¶ČµÄ±ä»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ___
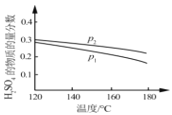
A.p2£¾p1£¬·“Ó¦¢ņµÄ¦¤S < 0
B.Ź¹ÓĆŗĻŹŹ“߻ƼĮæÉŅŌĢįøß H2SO4 ŌŚĘ½ŗāĢåĻµÖŠĪļÖŹµÄĮæ·ÖŹż
C.ĘäĖūĢõ¼žĻąĶ¬Ź±£¬Ķ¶ĮĻ±Č£Øn(SO2):n(H2O)£©øıäĪŖ 2:1£¬æÉĢįøß SO2 µÄĘ½ŗā×Ŗ»ÆĀŹ
D.µ±ČŻĘ÷ÄŚĘųĢåµÄĆÜ¶Č²»±äŹ±£¬æÉÅŠ¶Ļ·“Ó¦“ļµ½Ę½ŗāדĢ¬
E.ĪĀ¶ČÉżøߣ¬ÓŠĄūÓŚ·“Ó¦ĖŁĀŹ¼Óæģ£¬SO2 µÄĘ½ŗā×Ŗ»ÆĀŹĢįøߣ¬K Öµ±äŠ”
(2)”°ĮņµāŃ»·”±·ØŹĒ·Ö½āĖ®ÖĘĒāĘųµÄŃŠ¾æČČµć£¬Éę¼°ĻĀĮŠČżøö·“Ó¦£ŗ
·“Ó¦A£ŗSO2(g) + I2(aq) + 2H2O(l) £½ 2HI(aq) + H2SO4(aq)
·“Ó¦B£ŗ2HI(g) H2(g) + I2(g)
·“Ó¦C£ŗ2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
¢ŁÄ³ĪĀ¶ČĻĀ½« 1mol HI ³äČėĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦B£¬“ļµ½µŚ 1 “ĪĘ½ŗāŗó£¬ÓĆŃ”ŌńŠŌĤĶźČ«·ÖĄė³ö H2£¬“ļµ½µŚ 2 “ĪĘ½ŗāŗóŌŁ“Ī·ÖĄėH2£¬ÖŲø“¶ą“Ī£¬Ę½ŗāŹ± n(HI)ČēĻĀ±ķ£ŗ
“ļµ½Ę½ŗāµÄ“ĪŹż | µŚ 1 “Ī | µŚ 2 “Ī | µŚ 3 “Ī | µŚ 4 “Ī | µŚ 5 “Ī | ”” |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | ”” |
¹éÄɳö·ÖĄė H2 µÄ“ĪŹż¶Ō HI ×Ŗ»ÆĀŹµÄÓ°Ļģ________”£µŚ 2 “ĪĘ½ŗāŹ± I2 µÄĪļÖŹµÄĮæĪŖ n(I2)=_____mol£»
¢Ś·“Ó¦ A ·¢ÉśŹ±£¬ČÜŅŗÖŠĶ¬Ź±“ęŌŚŅŌĻĀ»ÆŃ§Ę½ŗā£ŗ I2(aq) + I(aq)![]() (aq)£¬Ęä·“Ó¦ĖŁĀŹ¼«æģĒŅĘ½ŗā³£ŹżŗÜ“ó”£ĻÖ½« 1mol SO2 »ŗ»ŗĶØČėŗ¬ 1 mol I2 µÄĖ®ČÜŅŗÖŠĒ”ŗĆĶźČ«·“Ó¦”£ĒėŌŚĻĀĶ¼ÖŠ»³öČÜŅŗÖŠ
(aq)£¬Ęä·“Ó¦ĖŁĀŹ¼«æģĒŅĘ½ŗā³£ŹżŗÜ“ó”£ĻÖ½« 1mol SO2 »ŗ»ŗĶØČėŗ¬ 1 mol I2 µÄĖ®ČÜŅŗÖŠĒ”ŗĆĶźČ«·“Ó¦”£ĒėŌŚĻĀĶ¼ÖŠ»³öČÜŅŗÖŠ![]() µÄĪļÖŹµÄĮæ n( I3- )Ėę·“Ó¦Ź±¼ä t ±ä»ÆµÄĒśĻßĶ¼____”£
µÄĪļÖŹµÄĮæ n( I3- )Ėę·“Ó¦Ź±¼ä t ±ä»ÆµÄĒśĻßĶ¼____”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ±ä»ÆÖŠ£¬ŹōÓŚĪüČČ·“Ó¦µÄŹĒ( )
¢ŁŅŗĢ¬Ė®µÄĘū»Æ ¢Ś½«µØ·Æ¼ÓČȱäĪŖ°×É«·ŪÄ©
¢ŪÅØĮņĖįĻ”ŹĶ ¢ÜKCl03·Ö½āÖĘŃõĘų
¢ŻÉśŹÆ»ŅøśĖ®·“Ӧɜ³ÉŹģŹÆ»Ņ
¢ŽCaCO3øßĪĀ·Ö½ā¢ßCO2+C![]() 2CO
2CO
¢ąBa(OH)2”¤8H2OÓė¹ĢĢåNH4Cl»ģŗĻ
¢įC(s)+H2O(g)![]() CO(g)+H2(g)¢āAlÓėŃĪĖį·“Ó¦
CO(g)+H2(g)¢āAlÓėŃĪĖį·“Ó¦
A. ¢Ś¢Ū¢Ü¢Ż¢Ž¢ß¢ą¢į B.¢Ś¢Ü¢Ž¢ß¢ą¢į C.¢Ś¢Ü¢Ž¢ą D.¢Ś¢Ū¢Ü¢ą¢į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅÓĆČ¼Éշزā¶Øij¹ĢĢåÓŠ»śĪļAµÄ·Ö×Ó×é³É£¬²ā¶Ø×°ÖĆČēĶ¼ĖłŹ¾(Ģś¼ÜĢØ”¢Ģś¼Š”¢¾Ę¾«µĘµČĪ“»³ö)£ŗ
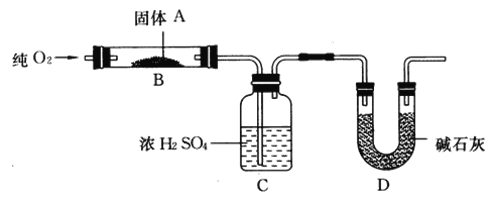
Č”17.1 g A·ÅČėB×°ÖĆÖŠ£¬ĶØČė¹żĮæO2Č¼ÉÕ£¬Éś³ÉCO2ŗĶH2O£¬Ēė»Ų“šĻĀĮŠÓŠ¹ŲĪŹĢā£ŗ
(1)ĶØČė¹żĮæO2µÄÄæµÄŹĒ________”£
(2)C×°ÖƵÄ×÷ÓĆŹĒ________£»D×°ÖƵÄ×÷ÓĆŹĒ________”£
(3)ĶعżøĆŹµŃ飬ÄÜ·ńČ·¶ØAÖŠŹĒ·ńŗ¬ÓŠŃõŌŖĖŲ£æ ___________________”£
(4)ČōAµÄĦ¶ūÖŹĮæĪŖ342 g/mol£¬C×°ÖĆŌöÖŲ9.9 g£¬D×°ÖĆŌöÖŲ26.4 g£¬ŌņAµÄ·Ö×ÓŹ½ĪŖ_____”£
(5)Š“³öAČ¼ÉյĻÆѧ·½³ĢŹ½£ŗ__________________”£
(6)AæÉ·¢ÉśĖ®½ā·“Ó¦£¬1 mol AæÉĖ®½āÉś³É2 molĶ¬·ÖŅģ¹¹Ģ壬ŌņAŌŚ“߻ƼĮ×÷ÓĆĻĀĖ®½āµÄ»Æѧ·½³ĢŹ½ĪŖ________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·“Ó¦4NH3£ØĘų£©£«5O2£ØĘų£©![]() 4NO£ØĘų£©£«6H2O£ØĘų£©ŌŚ10LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬°ė·ÖÖÓŗó£¬Ė®ÕōĘųµÄĪļÖŹµÄĮæŌö¼ÓĮĖ0.45mol£¬Ōņ“Ė·“Ó¦µÄĘ½¾łĖŁĀŹ¦Ō (X)(·“Ó¦ĪļµÄĻūŗÄĖŁĀŹ»ņ²śĪļµÄÉś³ÉĖŁĀŹ)æɱķŹ¾ĪŖ( )
4NO£ØĘų£©£«6H2O£ØĘų£©ŌŚ10LĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬°ė·ÖÖÓŗó£¬Ė®ÕōĘųµÄĪļÖŹµÄĮæŌö¼ÓĮĖ0.45mol£¬Ōņ“Ė·“Ó¦µÄĘ½¾łĖŁĀŹ¦Ō (X)(·“Ó¦ĪļµÄĻūŗÄĖŁĀŹ»ņ²śĪļµÄÉś³ÉĖŁĀŹ)æɱķŹ¾ĪŖ( )
A. ¦Ō(NH3)=0.0100mol”¤L-1”¤s-1B. ¦Ō(O2)=0.0010 mol”¤L-1”¤s-1
C. ¦Ō(NO)=0.0010 mol”¤L-1”¤s-1D. ¦Ō(H2O)=0.045 mol”¤L-1”¤s-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖŃé֤ľĢææɱ»ÅØH2SO4Ńõ»Æ³ÉCO2£¬Ń”ÓĆČēĶ¼ĖłŹ¾ŅĒĘ÷(ÄŚŗ¬ĪļÖŹ)×é×°³ÉŹµŃé×°ÖĆ(׏ĮĻ£ŗSO2ÄÜÓėĖįŠŌKMnO4·“Ó¦£ŗ2KMnO4 + 5SO2 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 )”£
¼×. ŅŅ.
ŅŅ. ±ū.
±ū.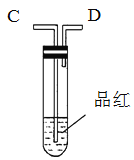 ¶”.
¶”.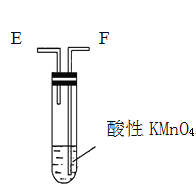
(1)Čē°“ĘųĮ÷ÓÉ×óĻņÓŅĮ÷Ļņ£¬Į¬½ÓÉĻŹö×°ÖƵÄÕżČ·Ė³ŠņŹĒ(Ģīø÷½ÓæŚ×ÖÄø)£ŗA½Ó________£¬________½Ó________£¬________½Ó________£»
(2)ŅĒĘ÷ŅŅ”¢±ūÓ¦ÓŠŌõŃłµÄŹµŃéĻÖĻó²Å±ķĆ÷ŅŃ¼ģŃé³öCO2”£ŅŅÖŠ_______£¬±ūÖŠ______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°½Ó“„·ØÖĘĮņĖį”±µÄÖ÷ŅŖ·“Ó¦ŹĒ2SO2+O2![]() 2SO3ŌŚ“߻ƼĮ±ķĆęµÄ·“Ó¦Ąś³ĢČēĻĀ£ŗ
2SO3ŌŚ“߻ƼĮ±ķĆęµÄ·“Ó¦Ąś³ĢČēĻĀ£ŗ
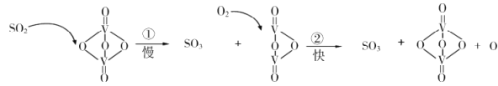
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.Ź¹ÓĆ“ß»Æ¼ĮÖ»ÄܼÓæģÕż·“Ó¦ĖŁĀŹB.·“Ó¦¢ŚµÄ»ī»ÆÄܱȷ“Ó¦¢Ł“ó
C.øĆ·“Ó¦µÄ“߻ƼĮŹĒV2O4D.¹ż³ĢÖŠ¼ČÓŠV”ŖO¼üµÄ¶ĻĮŃ£¬ÓÖÓŠV”ŖO¼üµÄŠĪ³É
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅŠčŅŖ 0.5mol/LµÄĮņĖįČÜŅŗ500mL”£øł¾ŻČÜŅŗµÄÅäÖĘĒéæö»Ų“šĻĀĮŠĪŹĢā”£
(1)øł¾Ż¼ĘĖćµĆÖŖ£¬ŠčĮæȔ֏Įæ·ÖŹżĪŖ98%”¢ĆܶČĪŖ1.84g/cm3µÄÅØĮņĖįµÄĢå»żĪŖ________mL”£
(2)ŌŚČēĶ¼ĖłŹ¾ŅĒĘ÷ÖŠ£¬ÅäÖĘÉĻŹöČÜŅŗæĻ¶Ø²»ŠčŅŖµÄÓŠ_________(ĢīŠņŗÅ)
A.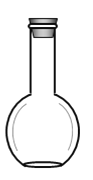 B.
B. C.
C.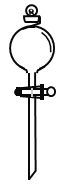 D.
D.![]()
(3)ŹµŃé²Ł×÷²½ÖčĪŖ£ŗ
A.°ŃÖʵƵÄČÜŅŗŠ”ŠÄµŲ×ŖŅĘÖĮČŻĮæĘæÖŠ”£
B.ĮæČ”ĖłŠčÅØĮņĖį £¬ŌŚÉÕ±ÖŠÓĆŹŹĮæµÄÕōĮóĖ®½«ĖüĻ”ŹĶ²¢ĄäČ“ÖĮŹŅĪĀ”£
C.¼ĢŠųĻņČŻĮæĘæÖŠ¼ÓÕōĮóĖ®ÖĮŅŗĆę¾ąæĢ¶Č1”«2cm“¦£¬øÄÓĆ½ŗĶ·µĪ¹ÜŠ”ŠÄµĪ¼ÓÕōĮóĖ®ÖĮČÜŅŗ°¼ŅŗĆęµ×²æÓėæĢ¶ČĻßĻąĒŠ”£
D.ÓĆÉŁĮæÕōĮóĖ®Ļ“µÓÉÕ±ŗĶ²£Į§°ō2”«3“Ī£¬Ćæ“ĪĻ“µÓµÄŅŗĢ嶼Š”ŠÄ×¢ČėČŻĮæĘ棬²¢ĒįĒįÕńµ“”£
E.½«ČŻĮæĘæČūČū½ō£¬³ä·ÖŅ”ŌČ”£
²Ł×÷²½ÖčµÄÕżČ·Ė³ŠņĪŖ_______(ĢīŠņŗÅ)”£
(4)ĻĀĮŠĒéæöÖŠ£¬»įŹ¹ĖłÅäČÜŅŗÅضČĘ«øߵďĒ_______(ĢīŠņŗÅ)”£
A.ĮæČ”ĖłŠčÅØĮņĖįijĶ¬Ń§¹Ū²ģŅŗĆꏱŃöŹÓ
B.ƻӊ½ųŠŠÉĻŹöµÄ²Ł×÷²½ÖčD
C.¼ÓÕōĮóĖ®Ź±£¬²»É÷³¬¹żĮĖæĢ¶ČĻß
D.ČŻĮæĘæŹ¹ÓĆĒ°ÄŚ±ŚÕ“ÓŠĖ®Öé
E.ÓĆÉŁĮæÕōĮóĖ®Ļ“µÓĮæČ”ÅØĮņĖįŗóµÄĮæĶ²£¬Ļ“µÓµÄŅŗĢå×¢ČėČŻĮæĘæ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com