
【题目】氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
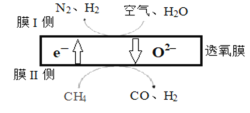
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________,膜Ⅱ侧发生的电极反应式为_________________
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H1
已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
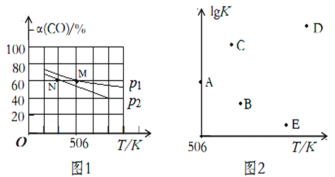
①压强p1_____(填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______(用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_______,n=_______。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) 2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
【答案】CH4 CH4+ O2—-2e—=CO+2H2 —90.1 kJ/mol > ![]() B、E 2 1 C D
B、E 2 1 C D
【解析】
(1)空气中N2和O2的物质的量之比为4:1,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,氮气的量在反应前后不变,则设氮气的物质的量为4mol,则生成氢气的物质的量为12mol,由膜I侧反应可知,12mol水得到电子,1mol氧气得到电子,做氧化剂,根据图示,膜Ⅱ侧CH4中C原子失去电子化合价升高转化为CO,被氧化,则氧化作用的物质为CH4,膜Ⅱ侧发生的电极反应式为CH4+ O2--2e-=CO+2H2;
(2)已知:①CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
②CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.1kJ/mol
根据盖斯定律:①+②可得CO(g)+2H2(g) CH3OH(g) △H1 =-90.1 kJ/mol;
(3)①在恒温恒压条件下发生反应:CO(g)+2H2(g) CH3OH(g)是气体体积减小的反应,增大压强,平衡向右移动,CO的转化率会增大,结合图1,保持温度不变转化率大的表示压强大,所以p1>p2;
M点时,CO的转化率为60%,则CO转化了1mol×60%=0.6mol,列“三段式”:
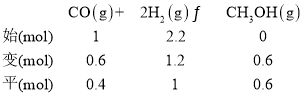
由上式可知平衡时的总物质的量=(0.4mol+0.6mol+1mol)=2mol,该反应的平衡常数Kp=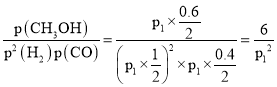 ;
;
②根据(2)分析,该反应放热,当温度越高时,平衡常数越小,则lgK也会越小,也就是说T与lgK呈反比关系,所以B、E两点符合lgK与温度(T)的关系;
(4)H2还原NO的反应为2NO(g)+2H2(g)N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①由编号1、编号2 组数据,保持c(H2)不变,则![]() ,代入1、2组数据,得
,代入1、2组数据,得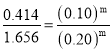 ,解得m=2,由编号2、编号3 组数据,保持c(N2)不变,则
,解得m=2,由编号2、编号3 组数据,保持c(N2)不变,则![]() ,代入2、3组数据,得
,代入2、3组数据,得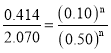 ,解得n=1;
,解得n=1;
②A.H2O2参与两个反应,但第一步未作反应物,因而不是催化剂,实际上H2O2仅是中间产物,故A错误;
B.总反应速率由慢反应决定,即由反应ⅰ的速率决定,故B错误;
C.反应ⅰ是慢反应,说明反应速率小,在其他条件一样的情况下,活化能较高,故C正确;
D.碰撞理论指出,能发生化学反应的碰撞是有效碰撞,即需要一定的能量和取向的碰撞,所以在所有的碰撞中只有部分碰撞是有效碰撞,故D正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】已知常温下反应:Fe3++AgFe2++Ag+的平衡常数K=0.3。现将含0.010mol/LFe(NO3)2和0.10mol/L Fe(NO3)3的混合溶液倒入烧杯甲中,将含0.10mol/L的AgNO3溶液倒入烧杯乙中(如图),闭合开关 K,关于该原电池的说法正确的是
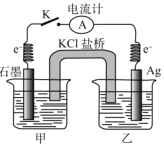
A.原电池发生的总反应中Ag+氧化Fe2+
B.盐桥中阳离子从左往右作定向移动
C.石墨为负极,电极反应为Fe2+-e-= Fe3+
D.当电流计指针归零时,总反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
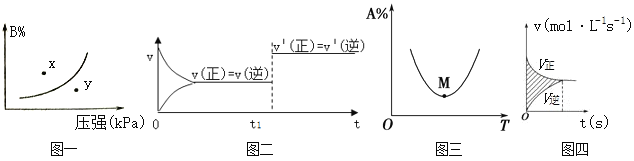
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素X、Y、Z、W、Q的原子序数依次增大。X与Y同周期且相邻,Y的基态原子的s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的原子核外价电子排布式为![]() ,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
,Q的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是( )
A.简单气态氢化物的稳定性:Y>X
B.简单离子的半径:Z>X>Y
C.Z的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由Y、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的原子轨道示意图,试回答下列问题:
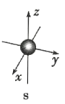
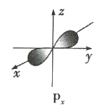
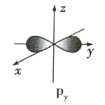
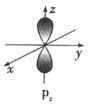
(1)若元素X的原子最外层电子排布式为![]() ,原子中能量最高的是 ____________ 电子,其电子云在空间内有 ____________ 个互相垂直的伸展方向;元素X的名称是 ____________ ,它的简单氢化物的电子式是 ____________ 。
,原子中能量最高的是 ____________ 电子,其电子云在空间内有 ____________ 个互相垂直的伸展方向;元素X的名称是 ____________ ,它的简单氢化物的电子式是 ____________ 。
(2)若元素X的原子最外层电子排布式为![]() ,那么X的元素符号为 ____________ ,原子的轨道表示式为 ____________ 。
,那么X的元素符号为 ____________ ,原子的轨道表示式为 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A.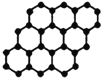 24g石墨烯中含有C-C键的个数为3NA
24g石墨烯中含有C-C键的个数为3NA
B.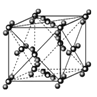 88g干冰中含有NA个晶胞结构单元
88g干冰中含有NA个晶胞结构单元
C.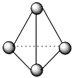 62gP4含有P-P键的个数为6NA
62gP4含有P-P键的个数为6NA
D.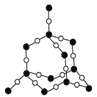 60gSiO2中含有Si-O键的个数为2NA
60gSiO2中含有Si-O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)下列基态原子或离子的电子排布式或轨道表示式正确的是_______(填序号,下同),违反能量最低原理的是_____,违反泡利不相容原理的是_____,违反洪特规则的是_______。
①Si:![]()
②Al:![]()
③Co3+最外层:![]()
④Mg2+:1s22s22p6
⑤Sc:1s22s22p63s23p63d3
⑥Cr:1s22s22p63s23p63d54s1
(2)物质:①甲烷 ②硫化氢 ③氢氧化镁 ④氨气 ⑤乙烯
条件 | 符合条件物质的序号 |
既含极性键又含非极性键 | ______ |
含有极性键的极性分子 | ______ |
上述分子中键角由大到小的顺序 | ______ |
(3)甲图FeO晶胞中与Fe2+最近的Fe2+的个数为__________;乙图晶胞中A、B两种微粒个数比为______;丙图晶胞中A、B两种微粒个数比为_________。
甲.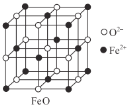 乙.
乙.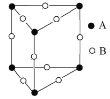 丙.
丙.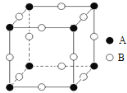
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
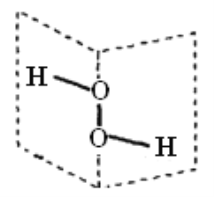
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 某烃与一定量的氧气恰好完全反应生成
某烃与一定量的氧气恰好完全反应生成![]() 及
及![]()
![]() ,若该烃与
,若该烃与![]() 只能按物质的量之比为
只能按物质的量之比为![]() 发生加成反应,则下列关于该烃的叙述错误的是( )
发生加成反应,则下列关于该烃的叙述错误的是( )
A.该烃的分子式为![]() B.该物质可能是炔烃或二烯烃
B.该物质可能是炔烃或二烯烃
C.该烃的键线式可能是![]() 或
或![]() D.该烃的官能团是碳碳双键
D.该烃的官能团是碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com