
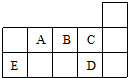
| A. | ED4分子中各原子均达8电子结构 | |
| B. | AD3和ED4两分子的中心原子均为sp3杂化 | |
| C. | A、B、C第一电离能的大小顺序为C>B>A | |
| D. | C、D气态氢化物稳定性强弱和沸点高低均为C>D |
分析 根据元素在周期表中的位置知,A、B、C、D、E分别是N、O、F、Cl、Si元素.
A.元素化合价绝对值与该元素原子最外层电子数之和等于8,分子中该原子最外层满足8电子结构;
B.计算中心原子价层电子对数,确定其杂化轨道;
C.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
B.元素的非金属性越强,其气态氢化物越稳定,气态氢化物属于分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的物质导致其熔沸点升高.
解答 解:根据元素在周期表中的位置知,A、B、C、D、E分别是N、O、F、Cl、Si元素.
A.SiCl4分子中Si的化合价为+4价,Cl的化合价为-1价,Si的原子最外层电子数为4,Cl的原子最外层电子数为7,则各原子都达到了8电子稳定结构,故A正确;
B.NCl3和SiCl4两分子的中心原子价层电子对个数都是4,所以均为sp3杂化,故B正确;
C.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以A、B、C第一电离能的大小顺序为C>A>B,故C错误;
D.元素的非金属性越强,其气态氢化物越稳定,气态氢化物属于分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的物质导致其熔沸点升高,非金属性F>Cl,且HF中含有氢键、HCl中不含氢键,所以C、D气态氢化物稳定性强弱和沸点高低均为C>D,故D正确,
故选:C.
点评 本题考查元素周期表和元素周期律的综合应用,涉及元素第一电离能、8电子结构、原子杂化方式判断等知识点,注意理解掌握同周期中第一电离能异常原因,注意氢键对于物质性质的影响.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入明矾可以使海水淡化,用于解决淡水供应危机 | |
| B. | 将地沟油回收再加工为食用油,以减缓水体富营养化 | |
| C. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| D. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与氯气反应 | B. | 次氯酸的分解 | ||
| C. | 乙醇与乙酸的酯化反应 | D. | 甲烷与氧气的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;属于共价化合物(填“共价”或“离子”);
;属于共价化合物(填“共价”或“离子”);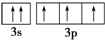 违背了泡利不相容原理;
违背了泡利不相容原理;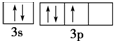 违背了洪特规则.
违背了洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:
如图是制备二氧化硫制取和吸收装置(加热装置已省略)分液漏斗中是液体反应试剂A,烧瓶中盛反应试剂B.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com