
分析 方法一:在加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
方法二:Cu和氧气在加热条件下反应生成CuO,CuO和稀硫酸反应生成硫酸铜和水;
工业方法:加热条件下,Cu和稀硫酸、氧气反应生成硫酸铜和水,Cu和浓硫酸反应生成大气污染物且使用的浓硫酸多.
解答 解:方法一:在加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
方法二:Cu和氧气在加热条件下反应生成CuO,CuO和稀硫酸反应生成硫酸铜和水,反应方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$22CuO、CuO+H2SO4=CuSO4+H2O;
工业方法:加热条件下,Cu和稀硫酸、氧气反应生成硫酸铜和水,反应方程式为2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,根据方程式知,制取相同物质的量的硫酸铜时,浓硫酸使用的多且与浓硫酸反应还生成有毒气体二氧化硫,污染大气,所以用Cu、稀硫酸和氧气制取硫酸铜较好,则用稀硫酸、氧气和Cu反应制取硫酸铜的优点是:不产生大气污染物且硫酸用量少,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;不产生大气污染物;硫酸用量少.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生比较分析判断能力,明确元素化合物性质是解本题关键,注意制备方案的选择既应考虑原料的消耗及环境问题,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 第二周期ⅣA族 | B. | 第三周期ⅣA族 | C. | 第四周期ⅣA族 | D. | 第二周期ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 0.01mol•L-1 KIO3 酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1 Na2SO3 溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加入乙醇和浓硫酸,然后加热 | |
| B. | 碳酸钠固体(碳酸氢钠):加热至恒重 | |
| C. | FeCl2溶液(FeCl3、CuCl2):加入过量Fe粉充分搅拌,然后过滤 | |
| D. | 乙醇(水):加入新制的生石灰,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
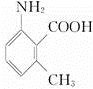 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的导电性 | B. | 金属的延展性 | ||
| C. | 地壳中金属元素的含量 | D. | 金属冶炼的难易程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的酸性逐渐增强 | B. | 碳棒逐渐溶解 | ||
| C. | 溶液中H+向铁片作定向移动 | D. | 铁片是负极并被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com