
| A. | Al (Fe):浓硝酸 | B. | MgO(Al2O3):盐酸 | ||
| C. | FeCl3(FeCl2):氯水 | D. | FeCl2(CuCl2):氢氧化氢钠溶液 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
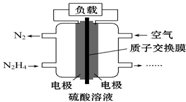 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 负极发生的电极反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 利用该燃料电池工业上可以电解MgCl2溶液制备Mg | |
| D. | 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图表示ⅥA族元素的氢化物的沸点 | |
| B. |  如图表示ⅦA族元素的熔点 | |
| C. |  如图表示Na+、Mg2+、Al3+的半径 | |
| D. |  如图表示第三周期元素的单质的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$、Cu2+、Cl-、NO${\;}_{4}^{2-}$ | B. | K+、Na+、CO${\;}_{3}^{2-}$、S2- | ||
| C. | K+、Na+、CH3COO-、SO${\;}_{4}^{2-}$ | D. | Ba2+、Mg2+、HCO${\;}_{3}^{-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的体积 /mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的N2和CO2 | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的O2和O3 | D. | 同压强、同体积的NO2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个N2分子与NA个CO分子的质量比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对质量之和 | |
| C. | 在常温常压下11.2LN2含有的分子数为0.5NA | |
| D. | 1mol•L-1NaCl溶液中、含有NA个Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com