
分析 (1)步骤②中沉淀表面主要杂质为为氯离子,可通过判断沉淀表面有没有氯离子判断沉淀是否洗涤干净;
(2)欲使溶液中c(SO42-)≤1.0×10-5mol•L-1,应保持溶液中c(Ba2+)≥$\frac{Ksp}{c(S{{O}_{4}}^{2-})}$,据此计算;
(3)以淀粉为指示剂,淀粉遇碘变蓝,当滴入最后一滴Na2S2O3溶液时,锥形瓶中溶液蓝色褪去,且半分钟内不恢复,即达到滴定终点;
(4)25.00mLA溶液中:
n(SO42-)=0.4660g/233g•mol-1=2×10-3mol
n(Fe3+)=0.1250mol•L-1×8.0×10-3L=1×10-3mol
根据电荷守恒:n(K+)=2×2×10-3mol-3×1×10-3mol=1×10-3mol
根据质量守恒,结晶水的物质的量:
[2.0120g×(25/100)-1×10-3mol×(39+56)mol•L-1-2×10-3mol×96g•mol-1]/18g•mol-1
=1.2×10-2mol
所以x:y:m:n=1:1:2:12,化学式为:KFe(SO4)2•12H2O.
解答 解:(1)步骤②中证明沉淀已洗涤干净的操作是取最后一次洗涤滤液,再滴加硝酸银,若溶液中不出现白色沉淀,则沉淀已洗涤干净,
故答案为:取最后一次洗涤滤液,再滴加硝酸银,若溶液中不出现白色沉淀,则沉淀已洗涤干净;
(2)欲使溶液中c(SO42-)≤1.0×10-5mol•L-1,应保持溶液中c(Ba2+)≥$\frac{Ksp}{c(S{{O}_{4}}^{2-})}$=$\frac{1.1×10{\;}^{-10}}{1.0×10{\;}^{-5}}$=1.1×10-5mol•L-1,
故答案为:1.1×10-5;
(3)以淀粉为指示剂,淀粉遇碘变蓝,当滴入最后一滴Na2S2O3溶液时,锥形瓶中溶液蓝色褪去,且半分钟内不恢复,即达到滴定终点,
故答案为:当滴入最后一滴Na2S2O3溶液时,锥形瓶中溶液蓝色褪去,且半分钟内不恢复;
(4)25.00mLA溶液中:
n(SO42-)=0.4660g/233g•mol-1=2×10-3mol
n(Fe3+)=0.1250mol•L-1×8.0×10-3L=1×10-3mol
根据电荷守恒:n(K+)=2×2×10-3mol-3×1×10-3mol=1×10-3mol
根据质量守恒,结晶水的物质的量:
[2.0120g×(25/100)-1×10-3mol×(39+56)mol•L-1-2×10-3mol×96g•mol-1]÷18g•mol-1=1.2×10-2mol,
所以x:y:m:n=1:1:2:12,化学式为:KFe(SO4)2•12H2O,
答:样品的组成为KFe(SO4)2•12H2O.
点评 本题涉及沉淀的洗涤、滴定原理的应用、铁钾矾的组成等有关计算,难度中等,注意溶度积的应用,计算铁钾矾的组成时要明确测定原理,根据电荷守恒、质量守恒计算出各组成成分的物质的量.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生眼镜反应 | |
| B. | 可用新制Cu(OH)2,鉴别甲酸、乙醛和乙酸 | |
| C. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| D. | 淀粉和纤维素互为同分异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| B. | 铜锌原电池工作时,电子从铜电极沿外电路流向锌电极 | |
| C. | 铅蓄电池的负极为PbO2,属于二次电池 | |
| D. | 锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
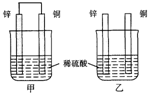
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 甲中铜片是正极,乙中铜片是负极 | |
| C. | 两烧杯中溶液的酸性均减弱 | |
| D. | 甲装置的导线中有电流,电流方向为锌→铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 电 极 | Zn C | Cu Ag | Zn Cu | Fe Zn |
| 溶 液 | 硫酸 | 硝酸银 | 蔗糖 | 硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| B. | 一个化学反应是吸热还是放热,取决于反应物和生成物总能量的相对大小 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com