
����Ŀ����������������Ҫ���л��ϳ��м��壬��һ�ֺϳ�·�����£�

�ش��������⣺
��1��A����ϩ������ṹ��ʽΪ____________________��
��2��B��C�ķ�Ӧ������_________________���÷�Ӧ���ɵ���C��Ϊͬ���칹��ĸ�������__________________��д�ṹ��ʽ����
��3��E�Ļ�ѧ������___________________________��
��4��д��D����E�Ļ�ѧ����ʽ_______________________________________________��
��5��H��һ��ͬ���칹��Ϊ��ϩ��������CH2��CH��COOC2H5����д���۱�ϩ��������NaOH��Һ��ˮ��Ļ�ѧ����ʽ_________________________________________________________��
��6��д��ͬʱ��������������G������ͬ���칹��__________________________________��
��д�ṹ��ʽ�������������칹����
�ٺ˴Ź�������Ϊ3����� ����ʹ������Ȼ�̼��Һ��ɫ��
��1mol��ͬ���칹������������NaHCO3��Ӧ����88g���塣
���𰸡� CH2=CH��CH3 �ӳɷ�Ӧ ![]() �����������
����������� 
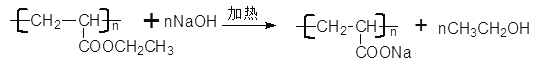 HOOC��CH2��CH=CH��CH2��COOH��
HOOC��CH2��CH=CH��CH2��COOH��![]()
����������1��A�ķ���ʽΪC3H6������ϩ����ӦΪ��ϩ����ṹ��ʽΪ CH2=CH��CH3��
��2��A����ȡ����Ӧ���ɵ�BΪ CH2=CH��CH2Br��B��HBr�����ӳɷ�Ӧ���ɵ�CΪBrCH2CH2CH2Br����B��HBr�ӳ�ʱ�����ַ�ʽ����÷�Ӧ���ɵ���C��Ϊͬ���칹��ĸ�������![]() ��
��
��3���л���![]() �Ļ�ѧ�����DZ������������
�Ļ�ѧ�����DZ������������
��4����D���Ҵ��������ɱ������������֪DΪ�����ᣬ��Ӧ�Ļ�ѧ����ʽΪ ��
��
��5���۱�ϩ��������NaOH��Һ��ˮ��Ļ�ѧ����ʽ ��
��
��6���ٺ˴Ź�������Ϊ3��壬˵���ṹ�Գ��ԱȽ�ǿ�� ����ʹ������Ȼ�̼��Һ��ɫ��˵������̼̼˫������1mol��ͬ���칹������������NaHCO3��Ӧ����CO288g��˵�����з��ӽṹ�к���2���Ȼ���������������G������ͬ���칹��ΪHOOC��CH2��CH=CH��CH2��COOH��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڻ�ѧ���ĸ��������У�����˵������ȷ���ǣ�������
A.�����ӻ������ֻ�������Ӽ�
B.���ۻ������һ�����������Ӽ�
C.�Ǽ��Լ�ֻ������˫ԭ�ӵĵ��ʷ�����
D.�ɷǽ���Ԫ����ɵĻ�������ֻ���ڹ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ��ʵ���ǣ�
A.������ʧ��B.���ϼ۵�����
C.��������������D.���ӵĵ�ʧ��ƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t ��ʱ��0.01 mol/L NaOH��ҺpH��11��0.1 mol/LHA��Һ��![]() ��109��
��109��
��1�����¶��£�ˮ�����ӻ�Kw��________��HA��________(�ǿ��������)�ᡣ
��2�����¶��£���pH֮��Ϊ13��NaOH��Һ��HA��Һ�������Ϻ�������Һ��_____(��ᡱ��������С�)�ԣ�������____________________________________��
��3���������£�������ˮϡ��0.01 mol/L HA��Һʱ�����гʼ�С���Ƶ���________��
A��![]() B��
B��![]() C����Һ��c(H��)��c(OH��)�ij˻�
C����Һ��c(H��)��c(OH��)�ij˻�
D����Һ��c(A��)��c(HA)��ֵ E��ˮ�ĵ���̶�
��4�������£�ȡpH��2�������HA��Һ��100 mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯����ͼ��ʾ��

��ͼ�б�ʾHA��ҺpH�仯���ߵ���________(�A����B��)��
���������м���Zn������Ϊm1��HA��Һ�м���Zn������Ϊm2����m1________m2(�����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B�ֱ�Ϊ0.6 mol��0.5 mol����0.4 L�ܱ������з�����Ӧ��3A��B![]() aC��2D����5 min��ʱCΪ0.2 mol����֪�ڴ˷�Ӧʱ���ڣ�D��ƽ����Ӧ����Ϊ0.1 mol��(L��min)��1�����н�����ȷ����(����)
aC��2D����5 min��ʱCΪ0.2 mol����֪�ڴ˷�Ӧʱ���ڣ�D��ƽ����Ӧ����Ϊ0.1 mol��(L��min)��1�����н�����ȷ����(����)
A. ��ʱ����Ӧ������ܵ����ʵ���Ϊ1 mol B. B��ת����Ϊ50%
C. A��ƽ����Ӧ����Ϊ0.1 mol��L��1��min��1 D. aֵΪ2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ij�ܱ������н������·�Ӧ��
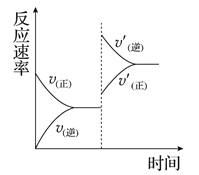
mA(g)��nB(g)![]() pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬
pC(g)��qD(g)��������ѹǿ�������¶ȣ����´ﵽƽ�⣬
��Ӧ������ʱ��ı仯������ͼ��ʾ����Ը÷�Ӧ��������ȷ����( )
A. ����Ӧ�����ȷ�Ӧ B. �淴Ӧ�Ƿ��ȷ�Ӧ
C. m��n<p��q D. m��n>p��q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾϸ����ijЩ�л����Ԫ����ɺ��ܹ�ϵ������A��B����Ԫ�أ������������ӣ�ͼ��X��Y��Z��P�ֱ�Ϊ�����������ӵĻ�����λ����ش��������⣺
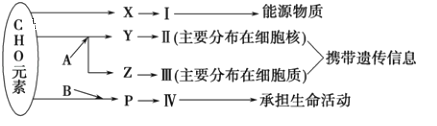
��1��ͼ��X��_____������С����������Ҫ��ָ_____��
��2��ͼ��Z��_____��ʹ�ü��̡�������ȾҺȾɫ����ʹ�����_____ɫ��
��3��ͼ��P�ĽṹͨʽΪ___________��д����P�γɢ��Ľṹ�������Ϊ________________________��
��4��������ʱ��ʹ��˫�����Լ���Ӧ�ȼ�_____����ɼ��Ի������ټ�_____�������Լ����ƣ�
��5��������ͼ�л�����Ľṹ���ش����⡣

�û������Тܱ�ʾ_______���û���������_____�ְ�����ͨ����ˮ���Ϸ�ʽ�γɵģ��û������____________������ȫˮ���Ϊ����������Ҫ_______��ˮ���ӡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ������벻����Ԫ�ء��ӹ����������仯�������������������е����÷����˾�仯��
��1���Ŵ��й��Ĵ���֮һ��˾��������Ȼ��ʯ�Ƴɵģ�����Ҫ�ɷ���______���ѧʽ����
��2���ִ���������������ѭ���ѽ�ˮ�������Ĺ�������ͼ��ʾ��
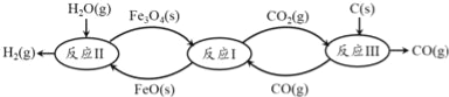
����֪��3FeO��s��+CO2��g��![]() Fe3O4��s��+CO��g����H1�T ��19.3kJmol��1
Fe3O4��s��+CO��g����H1�T ��19.3kJmol��1
Fe3O4��s��+H2��g��![]() 3FeO��s��+H2O��g����H2�T+57.2kJmol��1
3FeO��s��+H2O��g����H2�T+57.2kJmol��1
C��s��+CO2��g��![]() 2CO��g����H3�T +172.4kJmol��1
2CO��g����H3�T +172.4kJmol��1
��������ѭ���ѽ�ˮ�������ܷ�Ӧ���Ȼ�ѧ����ʽ��
C��s��+H2O��g���TH2��g��+CO��g����H�T_____________ ��
�������������¶�������أ����¶ȵ���570��ʱ��Fe3O4��s����CO��g����Ӧ�õ��IJ�����Fe��s����CO2��g�����谭ѭ����Ӧ�Ľ�������ͼ��ʾ��������һ��ʱ��Fe3O4��s����CO��g����Ӧ��ƽ��ʱCO��g��������ٷֺ������¶ȵı仯��ϵ��

i����ӦFe3O4��s��+4CO��g��![]() 3Fe��s��+4CO2��g����H______0����������������������=������������______��
3Fe��s��+4CO2��g����H______0����������������������=������������______��
ii���ڵ���570����ij�¶�ʱ������������Ӧ������COŨ�ȣ�C(CO)/C(CO2)��ֵ_______(�������С�������䡱)��
��3����18������һ�����е�˹�ͺյĵ¹��ˣ����������ʹ��Ϳ�ϵĹ��ˣ���˶Ը�������ɫ�����ʶ�����Ȥ����ʵ��ϳɳ����϶��������ɫȾ����³ʿ�������ĺϳɷ������£�
���ֽⷴӦii�Ļ�ѧ����ʽΪ______��
��������³ʿ���ϳ�ԭ��Ҳ�������ڼ��ʳƷ��CN����ͨ����ֽ���������֤��ʳƷ�к���CN���������̷������£�
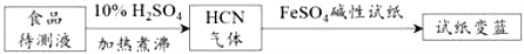
FeSO4������ֽ���ڼ��HCN�Ĺ���ԭ��Ϊ__________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com