
【题目】下列各组物质中,均属于共价化合物并且化学键类型完全相同的是( )
A. O2和CCl4B. NaH和HIC. Cl2和NH4NO3D. CCl4和H2SO4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B. 常温下, pH =12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C. 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D. 7.8 g Na2O2中含有的阴离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素T、Q、R、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是
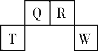
A. R的氢化物可以既有极性键又有非极性键
B. 常温下丁的浓溶液可用T单质所制的容器来盛装
C. 丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D. 甲、乙、丙、丁受热均易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.配制480 mL 0.3 mol/L NaOH溶液。具体如下:
(1)需_________g NaOH。
(2)配制过程中,下列仪器不会用到的是_____(填字母),尚缺少的玻璃仪器有_____、______。
A.托盘天平 B.250 mL容量瓶 C.玻璃棒 D.胶头滴管
(3)实验过程中两次用到玻璃棒,其作用分别是: _____________、_______________。
(4)下列操作的正确顺序是:B→_____→_____→____→____→____→G (用字母表示)。
A.冷却 B.称量C.洗涤 D.定容E.溶解 F.转移 G.摇匀
Ⅱ.乙同学用18.4 mol/L浓硫酸配制100 mL 3.6 mol/L的稀硫酸。用100 mL量筒量取20.0 mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,再搅拌均匀。你认为此法是否正确?________若不正确,指出其中错误之处______。
Ⅲ.在配制物质的量浓度溶液时,判断下列操作出现的后果。(填“偏低”、“偏高”或“无影响”)
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体:________。
(2)配制氢氧化钠溶液时,容量瓶中有少量水:_______。
(3)发现溶液液面超过刻度线,用吸管吸出少量水,使液面降至刻度:______。
(4)转移时不慎将溶液倒在瓶外:__________;
(5)定容时俯视容量瓶刻度线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A2(g)+B2(g)![]() 2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
2C(g) ΔH=-a kJ·mol-1(a > 0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1,放出热量b kJ。
(1)a___(填“>”“=”或“<”)b。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将__(填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量c kJ,C的浓度___(填“>”“=”或“<”)w mol·L-1。
(4)能说明该反应已经达到平衡状态的是___。(填序号,下同)
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内气体的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是___;能使B的转化率增大的操作是________;使平衡向逆反应方向移动的操作是________。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d..选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律和元素周期表,下列推断不合理的是( )
A. 第84号元素的最高化合价是+7
B. 第七周期0族元素的原子序数为118
C. 第35号元素的单质在常温常压下是液体
D. 位于第四周期第VA族的元素为非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应:A(s)+3B(g) ![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为1∶3∶2;⑥C的体积分数不再变化
A. ②④⑤ B. ①③④⑥
C. ①②④⑥ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探讨化学平衡移动原理与氧化还原反应规律的联系,实验如下。

下列说法不正确的是
A. 试管i溶液变蓝证明有I2生成
B. 结合试管i、ii中现象,可知2Fe3++2I-![]() 2Fe2++I2
2Fe2++I2
C. 试管iii中溶液褪色说明I2转化为I-,此时I-还原性强于Fe2+
D. 对比实验I和试管iii中现象,说明物质的氧化性与还原性强弱受浓度影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com