
 始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式(线表示C-C键,端点、交点表示碳原子)如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式(线表示C-C键,端点、交点表示碳原子)如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与乙烯互为同系物 | |
| B. | 若R1=R2=-CH3,则其化学式为C12H16 | |
| C. | 始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样的 | |
| D. | 若R1=R2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种 |
分析 A.根据同系物的定义判断;
B.根据结构简式来书写化学式;
C.烯烃使高锰酸钾褪色,体现了有机物的还原性,烯烃和溴水加成而使得溴水褪色;
D.始祖鸟烯环上两个不同的氢原子被氯原子取代后就得到其二氯代物.
解答 解:A.始祖鸟烯为环状烯烃,与乙烯结构不同,不互为同系物,故A错误;
B.若R1=R2=-CH3,则其化学式为C12H14,故B错误;
C.始祖鸟烯使高锰酸钾褪色,体现了始祖鸟烯的还原性,始祖鸟烯和溴水是发生了加成反应而使得溴水褪色,原理不同,故C错误;
D.碳原子位置可标识如图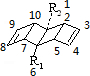 ,对应的二氯代物有2-3,2-4,2-5,2-7,2-8,2-9,2-10,5-7,3-4,3-7,共10种,故D正确.
,对应的二氯代物有2-3,2-4,2-5,2-7,2-8,2-9,2-10,5-7,3-4,3-7,共10种,故D正确.
故选D
点评 本题考查物质的结构与性质,为高频考点,侧重于学生的分析能力的考查,注意把握官能团与性质的关系,注重基础知识的考查,明确习题中的信息及烯烃的性质即可解答,易错点为同分异构体的判断,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
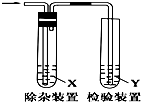 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
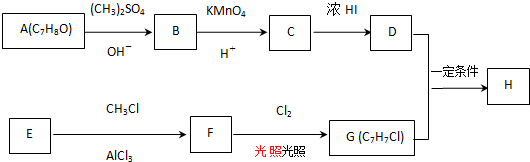
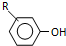 $→_{OH-}^{(CH_{3})_{2}SO_{4}}$
$→_{OH-}^{(CH_{3})_{2}SO_{4}}$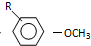 $\stackrel{浓HI}{→}$
$\stackrel{浓HI}{→}$
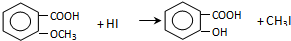 .
.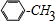 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$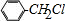 +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.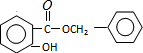 .
. (或
(或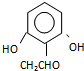 ).
).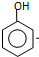 $\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$
$\stackrel{反应条件1}{→}$I$→_{OH-}^{(CH_{3})_{2}SO_{4}}$J$\stackrel{反应条件2}{→}$K$\stackrel{反应条件3}{→}$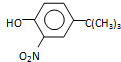 反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为
反应条件1所用的试剂为(CH3)3CCl/AlCl3,K的结构简式为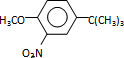 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向FeCl3溶液中滴加NaOH溶液 | 制备Fe(OH)3胶体 |
| B | 将CO2通入水玻璃溶液中 | 证明C元素的非金属性大于Si |
| C | 向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤 | 除去苯中混有的苯酚 |
| D | 淀粉与稀H2SO4共热,再加入银氨溶液水浴加热 | 验证淀粉水解产物有无还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,A与B在原子的电子层结构上的相同点是最外层均有4个电子.
,A与B在原子的电子层结构上的相同点是最外层均有4个电子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com