
 ,N2H4的结构式为:
,N2H4的结构式为: ;设烧瓶容积为1L,则氨气的物质的量为:
;设烧瓶容积为1L,则氨气的物质的量为:| 1L |
| 22.4L/mol |
| 0.045mol |
| 1L |
 ;
; ;0.045mol/L;
;0.045mol/L;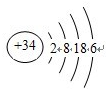 ,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,
,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,| 1 |
| 3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
B、 通过观察如图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C、用润湿的pH试纸测定饱和Na2CO3溶液pH |
| D、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积,比较两种酸的电离程度:醋酸<盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl、AgBr、AgI |
| B、AgI、AgBr、AgCl |
| C、AgBr、AgCl、AgI |
| D、三种沉淀同时析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和②混合溶液中:c(H+)=3.0mol?L-1 |
| B、①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
| C、②和③混合溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) |
| D、四种溶液稀释100倍,溶液的pH:③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、加热时,①上部汇集了固体NH4C1,说明NH4C1沸点很低,易升华 |
| B、四个“封管实验”中都发生了化学反应 |
| C、加热时,②、③溶液均变红,冷却后又都变为无色 |
| D、④中,左右相同的容器中分别充入相同的二氧化氮,浸泡在热水中的容器内二氧化氮的浓度小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镀锡铁板比镀锌铁板更耐腐蚀 |
| B、水常温下呈液态,冰浮在水面上,均与氢键有关 |
| C、用纯碱溶液清洗油污时,加热可增强其去污能力 |
| D、锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和溴水、铁屑混合制溴苯 |
| B、用溴水除乙烷中混有的乙烯 |
| C、苯与浓硝酸和浓硫酸的混合物共热至70℃~80℃制硝基苯 |
| D、用酒精和浓盐酸通过加热来制取乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com