
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |


科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与W相邻的同主族元素可制成重要的半导体材料 |
| B.元素原子半径从大到小的顺序是X、Y、Z |
| C.WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构 |
| D.W、Y、Z元素对应的氢化物稳定性最强的是H2Y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| R | | |
| X | Y | Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同主族元素从上到下,单质的熔点逐渐降低 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 类比对象 | 结论 |
| A | Cl2+H2O HCl+HClO HCl+HClO | I2+H2O HI+HIO HI+HIO |
| B | C+2CuO ="==" 2Cu+CO2↑(条件:加热) | C+SiO2 ="==" Si+ CO2↑(条件:加热) |
| C | Na2O+H2O ="=" 2NaOH | CuO+H2O ="=" Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.m – 13 = n | B.n + 5 = m | C.m + 8 = n | D.n – 11 =" m" |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属元素组成的化合物中只含共价键 |
| B.ⅠA族金属元素是同周期中金属性最强的元素 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
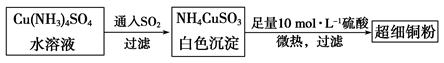
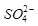 的空间构型为_____________,
的空间构型为_____________,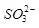 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。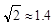 ,列式并计算结果)。
,列式并计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com