
| A. | 室温下,向1L 0.10mol•L-1 CH3COOH溶液中通人HCl至溶液pH=7时溶液中氯离子与醋酸根离子的微粒数目之和为0.2NA | |
| B. | 25℃时,1L pH=12的NaOH溶液中,由水电离的H+数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | H2SO4(浓)+H2S=SO2↑+S↓+2H2O反应中,生成64gSO2时,转移的电子数目为6NA. |
分析 A.醋酸溶液中通入氯化氢,溶液为酸性溶液;
B.氢氧化钠溶液中水的电离受到抑制;
C.氢氧燃料电池负极消耗1 mol H2时,电路中通过电子的数目为2NA,结合电极反应计算;
D.依据方程式H2SO4(浓)+H2S=SO2↑+S↓+2H2O,生成1mol二氧化硫转移2mol电子;
解答 解:A.常温下,醋酸溶液中通入氯化氢,溶液为酸性溶液,pH一定小于7,故A错误;
B.25℃时,1L pH=12的NaOH溶液中,水的电离受到抑制,由水电离的H+数目远远小于0.01NA,故B错误;
C.氢氧燃料电池负极消耗1 mol H2时,电路中通过电子的数目为2NA,故C正确;
D.生成64gSO2物质的量为1mol,依据方程式H2SO4(浓)+H2S=SO2↑+S↓+2H2O,转移的电子数目为2NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,侧重考查电子转移数目的计算,明确燃料电池的工作原理、氧化还原反应规律是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液中通入过量的CO2:CO2+2OH-═CO32-+H2O | |
| B. | Fe(NO3)3溶液中加入过量的浓HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| D. | NaHCO3溶液中加入少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
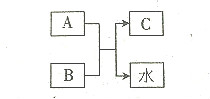 A.B.C均为中学化学常见物质,A、B、C含有同一种元素.且相同的元素不是氢或氧元素.A是一种强酸,B是-种弱碱,C是-种正盐,三者之间的转化关如图所示.则下列说法正确的是.
A.B.C均为中学化学常见物质,A、B、C含有同一种元素.且相同的元素不是氢或氧元素.A是一种强酸,B是-种弱碱,C是-种正盐,三者之间的转化关如图所示.则下列说法正确的是.| A. | C是硝酸盐 | B. | A是硫酸 | C. | B是氢氧化钠 | D. | A的摩尔质量最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下面是硫及其化合物的分类图,请回答下列问题:
下面是硫及其化合物的分类图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Mg2+、AlO2-、Zn2+、SO42- | B. | Na+、Ba2+、NO3-、OH-、SO42- | ||
| C. | K+、NO3-、SO42-、OH-、Na+ | D. | MnO4-、K+、Cl-、H+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com