
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。

①金属C的名称_______
②气体丙的分子式___________
③写出下列反应的化学方程式:反应①___________________________;反应⑥________________________ 。
【答案】铁 HCl 2Na+2H2O=2NaOH+H2↑ 3NaOH+FeCl3=Fe(OH)3↓+3NaCl
【解析】
金属A的焰色为黄色,即金属A为Na,Na与H2O反应,气体甲为H2,物质D为NaOH,金属B能与NaOH反应生成H2,则金属B为Al,气体甲与Cl2反应生成HCl,溶于水后生成盐酸,沉淀H为红褐色,H为Fe(OH)3,物质G中含有Fe3+,则物质F中含有Fe2+,即金属C为Fe,据此分析;
金属A的焰色为黄色,即金属A为Na,Na与H2O反应,2Na+2H2O=2NaOH+H2↑,气体甲为H2,物质D为NaOH,金属B能与NaOH反应生成H2,则金属B为Al,气体甲与Cl2反应生成HCl,溶于水后生成盐酸,沉淀H为红褐色,H为Fe(OH)3,物质G中含有Fe3+,氯气表现强氧化性,将Fe2+氧化成Fe3+,则物质F中含有Fe2+,即金属C为Fe,
①根据上述分析,金属C为Fe;
答案为铁;
②气体丙为HCl;
答案为HCl;
③反应①的化学方程式为2Na+2H2O=2NaOH+H2↑;反应⑥发生FeCl3+3NaOH=Fe(OH)3↓+2NaCl;
答案为2Na+2H2O=2NaOH+H2↑;FeCl3+3NaOH=Fe(OH)3↓+2NaCl。


科目:高中化学 来源: 题型:
【题目】(1)0.5 mol的Fe含___________个铁原子(用6.02×1023表示阿伏加德罗常数),质量是_______g;
(2)2mol CO2中含______ mol碳原子__________个氧原子(以NA为阿伏加德罗常数的值),________个质子(以NA为阿伏加德罗常数的值),标准状况下的体积为___________L,质量是______________g。
(3)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g,
①CO的质量为________
②混合气体的平均摩尔质量为________
③CO2的体积为________
④混合气体的密度为_____(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )

A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格列卫是治疗白血病和多种癌症的一种抗癌药物,在其合成过程中的一种中间产物结构表示如下:

下列有关该中间产物的说法不正确的是
A. 分子中可以发生水解反应的官能团有两种
B. 碱性条件下水解的产物之一,含有官能团—NH2
C. 碱性条件下水解的产物之一,经酸化后自身可以发生缩聚反应
D. 水解产物的单个分子中,苯环上都有3种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______。
②有利于提高混合气中CH4含量的措施是:_______。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是_______极(填“正”或“负”)。
②a极的电极反应式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气。化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用单线桥法表示该反应过程中的电子转移情况。______
(2)该反应中Cl2是___(填氧化剂、还原剂、氧化产物或还原产物),HCl被氧化部分和未被氧化部分之比为___。

已知:氯气有毒,溶入水显酸性(反应方程式为Cl2+H2O=HCl +HClO)。氯气在饱和食盐水中的溶解度很小,氯化氢在饱和食盐水中的溶解度则很大。
(3)装置C的作用是___,装置D的作用是____,为了避免尾气排入空气污染环境,装置F中的试剂是___。
(4)氯气与水反应过程中,氧化剂和还原剂之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计了如图所示的实验装置来进行实验探究:
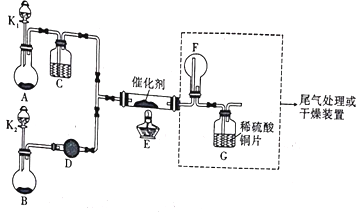
I.氨的催化氧化(4NH3+5O2 ![]() 4NO+6H2O):
4NO+6H2O):
(1)A中加入的是一种黑色的固体,B装置是制备___________的装置,D中装的试剂为___________。
(2)甲、乙同学分别按图示装置进行实验,一段时间后,装置G中的溶液都变成蓝色,甲观察到装置F中有红棕色气体,乙观察到装置F中有白烟生成。G中溶液变蓝的原因是(用离子方程式表示)______________________,白烟的成分为___________。甲、乙两同学分析了F装置现象不同的原因,乙同学通过改变实验操作:______________________,也在F中看到了红棕色气体生成。
Ⅱ.测定SO2转化为SO3的转化率:
已知:SO3的熔点是16.8℃,沸点是44.8℃。
(3)根据实验需要,应将F、G处替换成图中的装置(填序号)F.___________G._________。
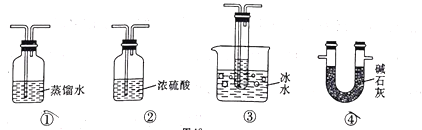
(4)在A中加入 a mol Na2SO3粉末与足量浓硫酸反应,当反应结束时,让B装置继续再反应一段时间,最后测得G处装置增重bg,则此时SO2的转化率为___________(用含a、b的代数式表示)。
(5)丙同学观察整套装置后,推断该实验结果必定偏高,他更换了一个三孔橡皮塞,改动装置后重新实验,获得了更符合实际的转化率。请推断他对装置的改动是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com