
| A. | 称量后转移固体时不小心把少量固体洒到烧杯外 | |
| B. | 加水定容时,加水过多,倒出后并恢复到刻度线水平 | |
| C. | 转移过程中不小心把几滴溶液滴在外面 | |
| D. | 干净的容量瓶又用蒸馏水洗涤了一遍 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使溶质的物质的量偏大,或者使溶液体积偏小的操作,都会导致溶液浓度偏高,反之溶液浓度偏低,据此分析解答.
解答 解:A.称量后转移固体时不小心把少量固体洒到烧杯外,导致溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.水定容时,加水过多,倒出后并恢复到刻度线水平,导致溶质的物质的量偏小,溶液浓度偏低,故B不选;
C.转移过程中不小心把几滴溶液滴在外面,导致溶质部分损耗,溶质的物质的量浓度偏低,故C不选;
D.干净的容量瓶又用蒸馏水洗涤了一遍,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故D选;
故选:D.
点评 本题考查了一定物质的量浓度溶液的配制,准确判断操作对溶质的物质的量和溶液体积的影响是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | CH3COONa | Na2S |
| pH | 7.5 | 9.5 | 11.8 |
| A. | 根据如,NaF的水解程度比CH3COONa的大 | |
| B. | 同体积、同pH的两种酸溶液消耗同浓度NaOH的体积:HF>CH3COOH | |
| C. | 向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况):c(CH3COOH)+c(H+)═c(OH-)+c(F-) | |
| D. | 若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,则溶液中离子浓度大小为:c(Cl-)>c(HS-)>c(OH-)c(S2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165kJ•mol-1 | |
| B. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ•mol-1 | |
| C. | B2H6(g)+3O2(g)═B2O3+3H2O△H=-2165kJ•mol-1 | |
| D. | B2H6(g)+O2(g)═B2O3(s)+H2O(l)△H=-2165kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4(CuSO4):加足量铁粉后,过滤 | |
| B. | CO(CO2):用NaOH溶液洗气后干燥 | |
| C. | MnO2(KCl):加水溶解后,过滤、洗涤、烘干 | |
| D. | N2(O2):通过灼热的氧化铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+Na2CO3、HCl+NaHCO3 | B. | BaCl2+Na2SO4、Ba(OH)2+NaHSO4 | ||
| C. | KOH+HCl、Ba(OH)2+H2SO4 | D. | 石灰石与硝酸、石灰石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、Na2CO3•10H2O、Ca(OH)2 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、生石灰 | D. | 硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
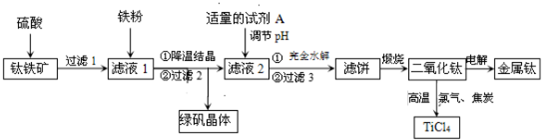
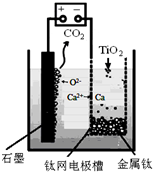
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com