
【题目】在密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
实验 序号 | 温度(℃) | 初始CO浓 度(mol·L-1) | 初始H2O浓 度(mol·L-1) | CO的平衡 转化率 |
1 | 110 | 1 | 1 | 50% |
2 | 100 | 1 | 1 | x |
3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后达到平衡,H2的平均反应速率为________mol·L-1·h-1。在此实验的平衡体系中,再加入0.5molCO和0.5molH2,平衡将________移动(“向左”、“向右”、“不”或“无法确定”)。
(2)实验2中,x的值________(填序号)。
A.等于50% B.大于50%
C.小于50% D.无法确定
(3)实验3中的y值为________。
(4)在100 ℃条件下,能说明该反应达到平衡状态的是________。
A.压强不再变化
B.生成H2O的速率和消耗H2速率相等时
C.混合气体的密度不变
D.H2的质量不再变化
【答案】 0.05 不 B 1.2 D
【解析】(1)实验1中,10h后达到平衡,CCl4的转化率为50%,
CCl4(g)+H2(g)CHCl3(g)+HCl(g),
起始(mol/L ) 1 1 0 0
反应(mol/L ) 0.5 0.5 0.5 0.5
平衡(mol/L) 0.5 0.5 0.5 0.5
![]() ,平衡常数k=
,平衡常数k=![]() ,在此实验的平衡体系中,再加入0.5molCCl4和0.5molHCl,设容积1L,此时浓度商Qc=1=k,反应平衡,不移动;
,在此实验的平衡体系中,再加入0.5molCCl4和0.5molHCl,设容积1L,此时浓度商Qc=1=k,反应平衡,不移动;
(2)由题知该反应是个放热反应,温度降低,平衡正向移动,CO的转化率增大;
故答案为:B;
(3)根据图象,实验3四氯化碳的转化率为60%,列三段式:
CCl4(g)+H2(g)CHCl3(g)+HCl(g),
起始(mol/L )0.8Y 0 0
反应(mol/L ) 048 0.480.48 0.48
平衡(mol/L) 0.32 Y-0.48 0.480.48
实验3与实验1的温度相同,则k=![]() =1,解得;Y=1.2;
=1,解得;Y=1.2;
已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在100℃条件下,是气体,CCl4+H2CHCl3+HCl△H<O,反应是气体体积不变的放热反应,A.反应前后气体体积不变,压强始终不变化,不能说明反应达到平衡状态,故A错误;B.生成HCl的速率和消耗H2的速率相等只能说明反应正向进行,不能说明反应达到平衡状态,故B错误;C.反应前后气体质量和体积不变,混合气体的密度始终不变,不能说明反应达到平衡状态,故C错误;D.H2的质量不再变化,说明氢气浓度不变是平衡标志,故D正确;故答案为:D。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】CO2经催化加氢可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是
C2H4(g)+4H2O(g)。0.1 MPa时,按n(CO2):n(H2)=l:3投料,测得不同温度下平衡时体系中各物质浓度的关系如图。下列叙述不正确的是

A. 该反应的△H<0
B. 曲线b代表H2O
C. N点和M点所处状态的c(H2)不一样
D. 其它条件不变,T1℃、0.2 MPa下反应达平衡时c(H2)比M点大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
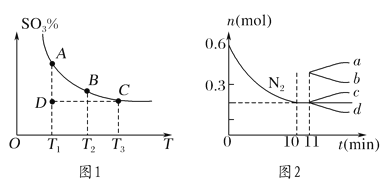
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作的原理或对应的离子方程式不正确的是
A. Mg(HCO3)2溶液中加入足量的Ba(OH)2:Mg2++2HCO3-+2Ba2++4OH-===Mg(OH)2↓+2BaCO3↓+2H2O
B. Na2S2O3溶液中加入稀硫酸:S2O32-+2H+===SO2↑+S↓+H2O
C. K2Cr2O7溶液中加入氢氧化钠溶液,溶液颜色由橙色变为黄色证明溶液中存在平衡:Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
D. 用浓盐酸酸化的KMnO4溶液与H2O2混合来证明H2O2具有还原性:2MnO4-+6H++5H2O2===2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在治疗创伤的中药方剂中,雄性羚羊角或犀牛角的用量极少,但是缺少这味药,疗效将大大下降甚至无效。已知动物的角主要是由死亡细胞的角化(变性)蛋白质组成的,则羚羊角等的有效成分最可能是
A. 特殊活性蛋白质 B. DNA
C. 微量元素类 D. 大量元素类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列大小关系正确的是( )
A. 晶格能:NaCl<NaBr B. 硬度:MgO>CaO C. 熔点:NaI>NaBr D. 熔沸点:CO2>NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
sabatior反应:CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
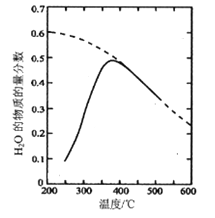
①己知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=___kJ/mol。
②温度过高或过低均不利于该反应的进行,原因是________。
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是______(填标号)。
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)![]() C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)![]() C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H
①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H___ 0(填“>”“<”或“不确定”) ;若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I 曲线b所示,则改变的条件是______________。
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____________(填“甲”或“乙”):m值为____________。

③Bosch反应必须在高温下才能启动,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列指定溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1Na2S溶液中:c(OH-)= c(H2S) + c(HS-)
B. 0.1mol·L-1 CH3COONH4溶液中:c(NH4+)+ c(NH3·H2O)=c(CH3COO-) +c(CH3COOH)
C. 0.1mol·L-1pH=6的NaHSO3溶液中:c(Na+) >c(HSO![]() ) >c(SO
) >c(SO![]() )>c(H2SO3)
)>c(H2SO3)
D. 0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合所得溶液中:c(CO![]() ) >c(HCO3-) >c(OH-) >c(H2CO3)
) >c(HCO3-) >c(OH-) >c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com