
【题目】将1.12 g铁粉加到25 mL 2 mol/L的氯化铁溶液中,完全反应后,其结果是
A. 铁有剩余,溶液呈浅绿色,c(Cl-)基本不变
B. 往溶液中滴加无色KSCN溶液,未显红色
C. 溶液中n(Fe2+)与n(Fe3+)之比为6∶1
D. 氧化产物与还原产物的物质的量之比为2∶5
【答案】C
【解析】铁粉的物质的量n=![]() =
=![]() =0.02mol,氯化铁的物质的量n=c×V=2molL-1×0.025L=0.05mol;铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+, 0.02mol铁粉完全反应需要0.04mol氯化铁。A.由于氯化铁剩余了0.01mol,铁完全反应,故A错误;B.氯化铁剩余,向溶液中滴入无色KSCN溶液,显血红色,故B错误;C.Fe2+的物质的量为0.06mol,氯化铁的物质的量为0.01mol,所以Fe2+和Fe3+的物质的量之比为6:1,故C正确;D.离子反应方程式为:Fe+2Fe3+=3Fe2+,由方程式可知氧化产物与还原产物的物质的量之比是 1:2,故D错误;故选C。
=0.02mol,氯化铁的物质的量n=c×V=2molL-1×0.025L=0.05mol;铁粉与氯化铁的离子反应方程式为:Fe+2Fe3+=3Fe2+, 0.02mol铁粉完全反应需要0.04mol氯化铁。A.由于氯化铁剩余了0.01mol,铁完全反应,故A错误;B.氯化铁剩余,向溶液中滴入无色KSCN溶液,显血红色,故B错误;C.Fe2+的物质的量为0.06mol,氯化铁的物质的量为0.01mol,所以Fe2+和Fe3+的物质的量之比为6:1,故C正确;D.离子反应方程式为:Fe+2Fe3+=3Fe2+,由方程式可知氧化产物与还原产物的物质的量之比是 1:2,故D错误;故选C。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】有关物质性质或用途的说法正确的是( )
A. 浓硫酸具有强氧化性,故不可用作干燥二氧化硫气体
B. 明矾可用作净水剂、晶体硅用来制作光导纤维
C. 稀硫酸中加入KNO3可使金属铜溶解
D. 氯气通入品红溶液中溶液褪色,说明Cl2具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是学习化学的基础,要通过实验去学习化学。
(1)下列关于实验的叙述中正确的有________。
A.不慎碰翻燃着的酒精灯使酒精在桌面上燃烧起来,应立即用湿抺布灭火
B.不慎将酸沾到皮肤或衣物上,应立即用浓NaOH溶液清洗
C.用托盘天平称量物品质量时,物品应置于右盘
D.实验时应节约药品,实验剩余的药品应放回原试剂瓶
E.可燃性气体点燃前一定要验纯
(2)请将下列错误实验操作可能会引起的不良后果填在表格中。
实验 | 向试管中加锌粒 | 对量筒中液体读数 | 浓硫酸的稀释 |
错误操作 |
|
|
|
不良后果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸钾、硫酸镁、硫酸铝三种溶液分别与相同体积、相同浓度的氯化钡溶液反应使Ba2+恰好完全沉淀,需要三种溶液的体积比为3∶2∶2,则三种溶液的溶质的物质的量浓度之比为( )
A. 3∶4∶2 B. 2∶3∶3 C. 6∶3∶1 D. 2∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产要遵守三大原则:充分利用原料、充分利用能量、保护环境。下列描述不符合以上原则的是
A. 煅烧硫铁矿时使用沸腾炉 B. 制盐酸时通入过量氯气使氢气反应完全
C. 制硫酸时使用热交换器 D. 氨碱法生产中循环使用氨气和二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)①氯胺(NH2Cl)的电子式为_______。
②工业上可利用Cl2和NH3反应制备氯胺,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol·L-1 NaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | x |
2 | 1.0 | 2.00 | y |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为__________。
(3)用焦炭还原NO的反应为:2NO(g) + C(s) ![]() N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为400 ℃、T ℃、400 ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
②该反应的ΔH___0 (填“>”或“<”)。
③丙容器达到平衡时,NO的转化率为___________。
(4)常温下,在NH4HCO3溶液中,c(NH4+)________c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年初,雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
I.汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),正反应为放热反应。
2CO2(g)+N2(g),正反应为放热反应。
(1)下列说法正确的是_______________。
A.装有尾气净化装置的汽车排出的气体中一定不再含有NO或CO
B.提高尾气净化效率的最佳途径是研制高效催化剂
C.升高温度可使该反应的正反应速率增大、逆反应速率减小
D.单位时间内消耗NO和CO2的物质的量相等时,反应达到平衡
(2)已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在线面实验设计表中,请在下表中的横线上填出合理数据:
实验编号 | t(℃) | NO初始浓度(10-3mol·L-1) | CO初始浓度(10-3mol·L-1) | 催化剂的比表面积(m2·g) |
① | 280 | 1.20 | 5.80 | 82 |
② | ______ | 1.20 | ______ | 124 |
③ | 350 | ______ | ______ | 82 |
实验①中,NO的物质的量浓度(c)随时间(t)的变化如下图所示。请在给出的坐标图中画出实验②、③中NO的物质的量浓度(c)随时间(t)的变化的曲线______,并标明各曲线的实验编号。
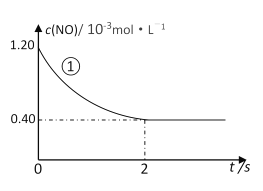
在280℃下,0~2 s内的平均反应速率v(N2) = ________________________。
II.直接排放煤燃烧产生的烟气会引起严重的环境问题。
(3)煤燃烧产生的烟气含氮的氧化物,用CH4催化还原氮氧化物(NOx)可以转化成无毒害的空气组分,从而消除氮氧化物的污染。请写出CH4催化还原NO2的化学方程式:_______________________________________________________。
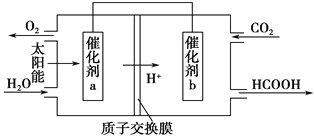
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右上图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂a表面发生_______反应(填“氧化”或“还原”),总反应的化学方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com