
| A. | 杀死水果周围的细菌,防止水果霉变 | |
| B. | 吸收水果周围的氧气,防止水果腐烂 | |
| C. | 吸收水果产生的乙烯,防止水果早熟 | |
| D. | 氧化性较强,催熟水果 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | pH=1的水溶液中:Al3+、NH4+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
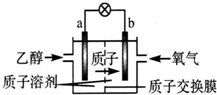 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A. | a极为电池的正极 | |
| B. | 电池正极的电极反应:4H++O2+4e-═2H2O | |
| C. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| D. | 设每个电子所带电量为q库仑,则1 mol乙醇被氧化产生12q库仑的电量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
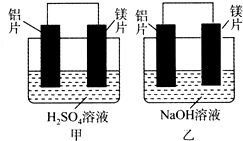 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol•L-1的H2SO4溶液中,乙同学将电极放入6 mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol•L-1的H2SO4溶液中,乙同学将电极放入6 mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
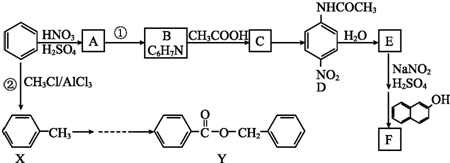
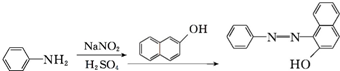
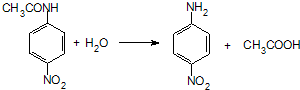 .
.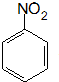 、F
、F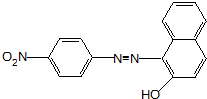 .
.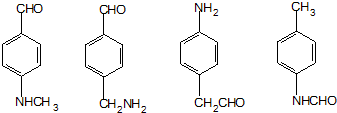 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别加入碘水,观察颜色反应 | |
| B. | 分别加稀硫酸煮沸,再加足量NaOH溶液调至碱性,加银氨溶液加热观察有无银镜 | |
| C. | 分别加热水溶解,观察溶解性 | |
| D. | 放在嘴里咀嚼,有无甜味产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A浓度表示该反应速率为1.6 mol/(L•min) | |
| B. | 若使容器体积变为1 L,则B的物质的量一定减小 | |
| C. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| D. | 若向容器再充入1 mol C,重新达到平衡,A的体积分数保持不变,则B为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com