
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
分析 (1)根据1molSO2与氯酸钠在酸性条件下反应生成ClO2,说明氯酸钠作氧化剂将SO2氧化成硫酸钠,自身被还原成ClO2,据此分析计算;
(2)水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)的焓变等于旧键断裂吸收的能量和新键生成释放能量的差;
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A为Na2S,Na2S溶液在空气中长期放置发生反应,生成物之一为B,B与过氧化钠的结构和化学性质相似,则B为Na2S2,据此分析解答;
(4)碘离子与溴离子的还原性强弱顺序为:I->Br-,加入氯气2.8L时溶液中I-amol,则说明通入2.8LCl2只发生:Cl2+2I-═I2+2Cl-,2.8L变成5.6L,消耗2.8L Cl2的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,先后发生:Cl2+2I-═I2+2Cl-,Cl2 +2Br-═Br2+2Cl-,根据反应方程式计算.
解答 解:(1)由1molSO2与氯酸钠在酸性条件下反应生成ClO2,说明氯酸钠作氧化剂将SO2氧化成硫酸钠,自身被还原成ClO2,所以氧化产物为Na2SO4,转移电子1mol×(6-4)=2mol.故答案为:Na2SO4;2;
(2)由焓变等于旧键断裂吸收的能量和新键生成释放能量的差得,COS(g)+H2O(g)═H2S(g)+CO2(g)△H2=(742+465×2)-(339+803)=-35kJ/mol,故答案为:-35;
(3)H2S被足量氢氧化钠溶液吸收得到无色溶液A为Na2S,Na2S溶液在空气中长期放置发生反应,生成物之一为B.B与过氧化钠的结构和化学性质相似,则B为Na2S2,所以B的溶液与稀硫酸反应的化学方程式为Na2S2+H2SO4=Na2SO4+S↓+H2S↑,故答案为:Na2S2+H2SO4=Na2SO4+S↓+H2S↑;
(4)①2.8L氯气的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,通入0.125mol氯气时溶液中有I-,所以Br-没有参加反应,所以溶液中n(Br-)=1.5mol,溶液中氯离子为通入氯气生成的和原来溶液中存在的,Cl原子守恒得原来n(Cl-)=1.25mol-0.125mol×2=1mol;通入0.25mol氯气时溶液中没有I-,则碘离子完全反应,且n(Br-)=1.4mol,说明有0.1mol溴离子参加反应,则碘离子完全反应,根据转移电子相等得n(I-)=0.25mol×2-0.1mol×1=0.4mol,根据反应:Cl2+2I-═I2+2Cl-,该反应中生成0.25mol氯离子消耗碘离子,所以a=0.5mol-0.25mol=0.15mol,故答案为:0.15;
②通过以上分析知,当通入Cl2的体积为3.36L即0.15mol(标准状态下)时,溶液中发生反应的离子方程式为Cl2+2I-=2Cl-+I2;n(Cl-)=1mol、n(Br-)=1.5mol、n(I-)=0.4mol,溶液体积相同,c(Br-)=$\frac{1.5mol}{2L}$=0.75mol/L,c(I-)=$\frac{1mol}{2L}$=0.5mol/L,
故答案为:Cl2+2I-=2Cl-+I2;0.75mol/L;0.5mol/L.
点评 本题主要考查了氧化还原反应的计算、盖斯定律、物质推断以及离子的判断和有关计算,难点为(4),准确分析图标数据是解题关键,题目难度中等,注意根据离子的还原性以及表中数据判断反应的程度,结合方程式计算.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
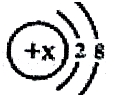 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
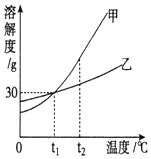 图是甲、乙两种固体物质的溶解度曲线.
图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去镁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 用明矾净水是因为Al3+水解生成的胶状Al(OH)3具有很强的吸附性 | |
| C. | 在相同浓度的盐酸中,纯铁比含碳量较高的生铁反应速率快 | |
| D. | 冶金工业中可以利用铝热反应原理冶炼钒、铬、锰等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④ | C. | ①⑤ | D. | ④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com