
| A、当H2与NH3生成速率为3:2时,反应一定达到平衡状态 |
| B、H2与N2的转化率一定相等 |
| C、c1一定等于0.14mol?L-1 |
| D、c3的取值范围为:0<c3<0.28mol?L-1 |


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |


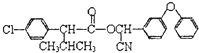 );
);
| H2O |
| H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题:
在陕西省高新技术开发区的应用材料公司、三星企业、光伏产业、光纤产业中,硅都发挥着重要的作用,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
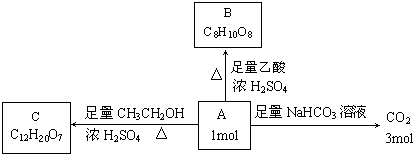
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

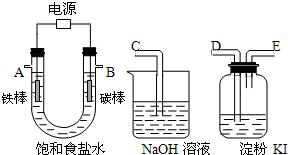
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com