
【题目】下列化学变化中,需加入氧化剂才能实现的是( )
A.HCl→Cl2B.MnO4-→Mn2+C.CuO→CuD.SO2→SO32-
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

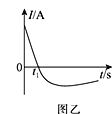
t1s前,原电池的负极是铝片,正极的电极反应式为________,溶液中的H+向______(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)实验室用硫酸亚铁溶液和草酸制备水合草酸亚铁,反应的化学方程式为___________。
(2)将水合草酸亚铁溶于适量盐酸。分别取2mL此溶液于3支试管中,进行实验:能证明水合草酸亚铁中存在Fe2+的试剂有______(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(3)为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。

实验步骤如下:
a.打开K1和K2,缓缓通入N2;
b.低温加热装置A一段时间;
c.停上加热,冷却到室温;
d.关闭K1和K2,称量A;
e._______________,记为m3g。
①补充实验步骤e为____________________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是______________________________________。
③根据实验数据记录,计算水合草酸亚铁化学式中结晶水数目x=________(列式表示)。
(4)为探究草酸亚铁的分解产物,将(3)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
①实验装置中,依次连接的合理顺序为A→___________________________。
②证明产物有CO生成的现象是__________________________________。
③写出草酸亚铁受热分解的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某处温泉有“圣水”之美誉,经常洗浴对治疗各种皮肤病、神经衰弱等有特殊的功效。经专家鉴定泉水中含有人体生命活动所需的微量元素,它们可能是
A.Fe、Mn、Zn、MgB.Zn、Cu、Mn、Ca
C.Zn、Cu、B、MnD.Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组实验室制取乙酸乙酯时查阅资料如下:
主反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
副反应:2CH3CH2OH![]() CH3CH2OCH2CH3(乙醚)+H2O
CH3CH2OCH2CH3(乙醚)+H2O
CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
根据查得的资料设计了下图所示的装置(夹持装置忽略)制取纯净的乙酸乙酯。

步骤如下:
①在图1的三口烧瓶中加入3mL乙醇,边摇动边慢慢加入3mL浓硫酸,在分液漏斗中装入3:2的乙醇和乙酸混合液。
②油浴加热三口烧瓶至一定温度,然后把分液漏斗中的混合液慢慢地滴入三口烧瓶里并保持反应混合物在一定温度。
③反应一段时间后,向锥形瓶中缓慢加入饱和Na2CO3溶液,并不断摇动,分层后进行分液。
④用饱和食盐水和氯化钙溶液洗涤酯层,再分液,在酯层加入干燥剂干燥得粗乙酸乙酯。
⑤将粗乙酸乙酯转入图2的仪器A中,在水浴中加热,收集74~80℃的馏分即得纯净的水果香味无色透明液体。
根掲题目要求回答:
(1)在实验中浓硫酸的作用______;混合液加热前都要加入碎瓷片,作用是________。
(2)歩驟②中油浴加热保持的一定温度范围_____,原因是________。
(3)图2中仪器A的名称是_____,冷凝管中冷水从______(填a或b)口进入。
(4)步骤③和④中都用到了分液操作,该操作用到的主要玻璃仪器是_____,在分液操作时,上下两层液体移出的方法是____________。
(5)步骤④中干燥乙酸乙酯,可选用的干燥剂为______(填字母)。
a.五氧化二磷 b.无水Na2SO4 c.碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强。下列说法中正确的是
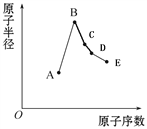
A. B离子的半径比C离子的半径小
B. C单质与A或E单质形成的化合物均为离子化合物
C. A、B两单质反应可得到两种不同的离子化合物
D. B最高价氧化物对应的水化物与0.1mol D单质充分反应放出4.48L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com