
【题目】能正确表示下列反应的离子方程式是( )
A.![]() 溶液与少量
溶液与少量![]() 溶液反应:
溶液反应:![]()
B.电解![]() 水溶液:
水溶液:
C.乙酸乙酯与![]() 溶液共热:
溶液共热:![]()
D.![]() 溶液中滴加稀氨水:
溶液中滴加稀氨水:![]()
【答案】C
【解析】
A.(NH4)2Fe(SO4)2可以写成(NH4)2SO4FeSO4,(NH4)2Fe(SO4)2溶液与少量Ba(OH)2溶液反应, OH-先与Fe2+反应,再和![]() 反应,由于Ba(OH)2较少,
反应,由于Ba(OH)2较少,![]() 不会参与反应,离子方程式为:Fe2++
不会参与反应,离子方程式为:Fe2++![]() + Ba2++ 2OH-=Fe(OH)2↓+BaSO4↓,A错误;
+ Ba2++ 2OH-=Fe(OH)2↓+BaSO4↓,A错误;
B.用惰性材料为电极电解MgCl2溶液,阳极反应为:2Cl--2e-=Cl2↑,阴极反应为:2H2O+2e-+Mg2+=Mg(OH)2↓+H2↑,总反应的离子方程式为:Mg2++2Cl-+2H2O= Mg(OH)2↓+H2↑+ Cl2↑,B错误;
C.乙酸乙酯与氢氧化钠溶液共热时发生水解,生成乙酸钠和乙醇,离子方程式为:CH3COOCH2CH3+OH-![]() CH3COO-+CH3CH2OH,C正确;
CH3COO-+CH3CH2OH,C正确;
D.向硫酸铜溶液中滴加氨水,氨水与硫酸铜发生复分解反应生成氢氧化铜沉淀和硫酸铵,一水合氨为弱电解质,在离子反应中不能拆开,离子方程式为:Cu2++2NH3H2O=2![]() +Cu(OH)2↓,D错误。
+Cu(OH)2↓,D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可用于照相业作定影剂、纸浆漂白作脱氯剂等。实验室用SO2通入Na2S和Na2CO3的混合液中来制备硫代硫酸钠。
本实验对Na2S纯度要求较高,利用图1所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯过程为:将已称量好的工业级Na2S放入圆底烧瓶中,加入一定质量的酒精和少量水。按图1所示装配所需仪器,向冷凝管通入冷却水,同时水浴加热。待烧瓶中固体不再减少时,停止加热。将烧瓶取下,立即趁热过滤,再冷却结晶,抽滤。将所得固体洗涤、干燥,得到Na2S9H2O晶体。
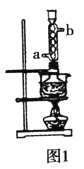
(1)下列说法不正确的是___。
A.将晶体转移至布氏漏斗时,若器壁上粘有少量晶体,应用冷水淋洗
B.抽滤时,为防止滤纸穿孔,可适当关小水龙头或多加一层滤纸
C.洗涤时,可用一定浓度的乙醇溶液洗涤晶体,目的是洗除晶体表面的杂质,易于得到干燥晶体
D.为加快产品的干燥,可高温烘干
E.在提纯过程中“趁热过滤”操作的目的是防止硫化钠结晶析出而损失、去除杂质
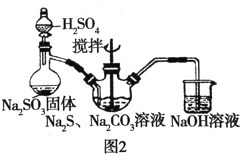
(2)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是________,三颈烧瓶中发生反应的化学方程式__________。
(3)硫代硫酸钠样品中Na2S2O35H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol/L碘的标准溶液进行滴定。请回答:
①达到滴定终点的标志是_______。
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为_______ mL,产品纯度为________(设Na2S2O35H2O相对分子质量为M)。
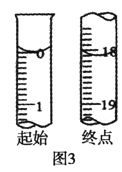
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O35H2O的纯度的测量结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24LHF中含有的极性键数目为0.1NA
B.18g重氢氨基(-ND2)中含有的电子数为10NA
C.33.6L氯气与足量铝充分反应,转移电子数为3NA
D.7g乙烯和丙烯混合气体中的氢原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法不正确的是( )
A. 萃取![]() 时,向盛有溴水的分液漏斗中加入
时,向盛有溴水的分液漏斗中加入![]() ,振荡、静置分层后,打开旋塞,先将水层放出
,振荡、静置分层后,打开旋塞,先将水层放出
B. 做焰色反应前,铂丝用稀盐酸清洗并灼烧至火焰呈无色
C. 乙醇、苯等有机溶剂易被引燃,使用时须远离明火,用毕立即塞紧瓶塞
D. 可用![]() 溶液和稀
溶液和稀![]() 区分
区分![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A. B.
B.
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
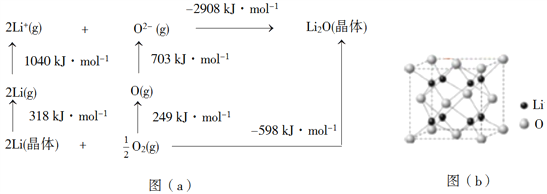
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的有
①![]() 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
③运用价层电子对互斥理论,![]() 离子的空间构型为三角锥型
离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3 中 N-Cl 键的键长比 CCl4 中 C-Cl 键的键长短
A.1 个B.2 个C.3 个D.4 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 氨水滴定
氨水滴定![]() 浓度均为
浓度均为![]() 的
的![]() 和
和![]() 的混合液,下列说法不正确的是( )
的混合液,下列说法不正确的是( )
A. 在氨水滴定前,![]() 和
和![]() 的混合液中
的混合液中![]()
B. 当滴入氨水![]() 时,
时,![]()
C. 当滴入氨水![]() 时,
时,![]()
D. 当溶液呈中性时,氨水滴入量大于![]() ,
,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3,含少量SiO2,Fe2O3和A12O3)为原料制备高纯镁砂的工艺流程如下:
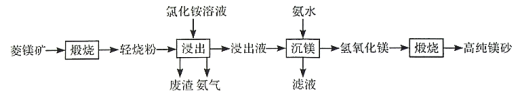
已知浸出时产生的废渣中有SO2,Fe(OH)3和Al(OH)3。下列说法错误的是
A.浸出镁的反应为![]()
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有NH3、NH4Cl
D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com