


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、配制比室温高10~20℃明矾饱和溶液然后浸入悬挂的明矾小晶核,静置过夜 |
| B、在沸水中配制明矾饱和溶液,然后急速冷却结晶 |
| C、室温下,在明矾饱和溶液中投入明矾小晶核,静置过夜 |
| D、进行快速蒸发明矾饱和溶液至大量晶体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时,石墨做阴极,铁作阳极 |
| B、电解时,在阳极上产生氢气 |
| C、电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧 |
| D、电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| I1/kJ?mol-1 | I2/kJ?mol-1 | I3/kJ?mol-1 | I4/kJ?mol-1 | I5/kJ?mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
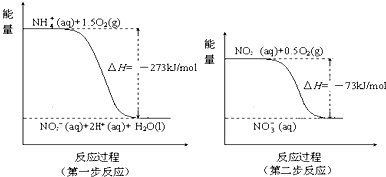
科目:高中化学 来源: 题型:
查看答案和解析>>
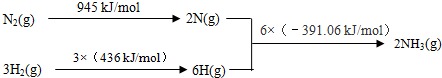
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
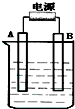 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com