
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | 100mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA | |||||||||||
| C. | 已知:
 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
分析 A.H2O(g)?H2O(l) 的△H应小于0;
B.根据电荷守恒:N(H+)=N(OH-)+N(ClO-)+N(Cl-)分析;
C.甲苯中不存在C=C键,根据表中数据无法计算;
D.NH3•H2O溶液中存在电离平衡,根据影响电离平衡的因素分析.
解答 解:A.液态水的气化热为40.69kJ•mol-1,则H2O(g)?H2O(l) 的△H=-40.69 kJ•mol-1,故A错误;
B.100mL pH=2的新制氯水中,溶液中的电荷守恒:N(H+)=N(OH-)+N(ClO-)+N(Cl-),N(H+)=0.001NA,则N(OH-)+N(ClO-)+N(Cl-)=0.001NA,故B错误;
C.甲苯中不存在C=C键,根据表中数据无法计算,所以不能计算出反应的反应热,故C错误;
D.NH3•H2O为弱电解质,存在电离平衡,为NH3•H2O?NH4++OH-,加入少量NH4Cl晶体,c(NH4+)浓度增大,平衡向逆反应方向移动,能使NH3•H2O的电离度降低,溶液的pH减小,故D正确.
故选D.
点评 本题综合考查化学反应与能量的变化、弱电解质的电离平衡移动,侧重于学生的分析能力和基本理论的综合应用的考查,易错点为C,注意苯环不含C=C的特点,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
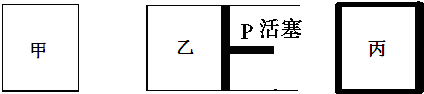
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①⑤⑥ | C. | ②③④ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g 苯中含有的单键数目为0.9NA | |
| B. | 1 mol Cl2溶于水,与水反应时电子转移数目为1 NA | |
| C. | 在298K 1.01×105pa下,22 g CO2和N2O混合气体中,所占的体积大于11.2升 | |
| D. | 常温下,pH=13的NaOH溶液中含有的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 溶液中一定有SO42-,可能有K+、Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量前应将Na2CO3•xH2O灼烧至恒重 | |
| B. | 配制时需用托盘天平称取4.8 g无水Na2CO3 | |
| C. | 100 mL上述溶液含离子总数为0.03NA | |
| D. | 配制好的Na2CO3溶液应转移到带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烯分子中有7个σ键,2个π键 | |
| B. | 在60 g SiO2晶体中,Si-O键的数目为2NA | |
| C. | l mol金刚石中,含2 mol C-C键 | |
| D. | 由ⅠA族和ⅥA族元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com