
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 | |
| C. | 燃烧热或中和热都是反应热的种类之一 | |
| D. | 其他条件一样时,氢气与氧气反应生成液态水和气态水时所放出的热量相等 |
分析 A.依据燃烧热的定义分析解答;
B.中和热:在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热;
C.燃烧热或中和热属于反应热;
D.气态水转化为液态水还要放出热量.
解答 解:A.在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,故A错误;
B.中和热:在稀溶液中,强酸跟强碱发生中和反应生成1 mol水时的反应热叫做中和热,故B错误;
C.反应热指等温下化学反应释放或吸收的热量,燃烧热或中和热是一定条件下的反应热,故C正确;
D.其他条件一样时,氢气与氧气反应生成液态水放出的热量大于生成气态水放出的热量,故D错误;
故选C.
点评 本题考查了中和热和燃烧热的概念以及应用,题目难度不大,注意物质的状态以及概念的辨析.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 还原性强弱:Cl-<Br-<I- | D. | 碱性强弱:KOH>NaOH>LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
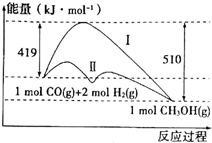 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),反应过程中的能量变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
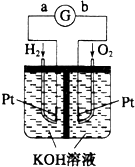
 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应热指的是反应过程中放出的热量 | |
| B. | 原电池的负极发生氧化反应 | |
| C. | 伴随能量变化的不一定是化学变化 | |
| D. | 电解池的阳极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 解释或结论 | |
| A | 向Na2CO3浓溶液中通入足量CO2溶液变浑浊 | 溶解度:NaHCO3<Na2CO3 |
| B | 常温下相同浓度NaHCO3溶液的pH大于NaHSO3的pH | 酸性:H2CO3<H2SO3 |
| C | 向2mL 1mol/LAlCl3溶液中加入几滴1mol/LNaOH溶液,生成白色沉淀,再加入几滴1mol/LFeCl3溶液,沉淀变为红褐色 | Ksp:Al(OH)3>Fe(OH)3 |
| D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
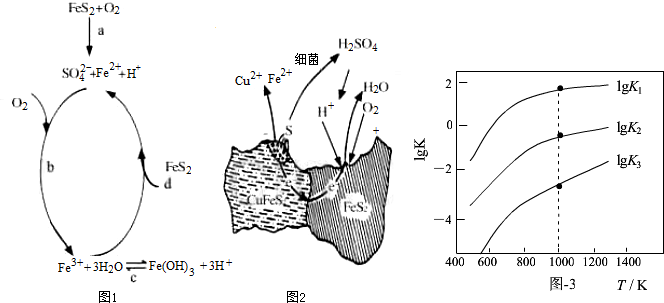
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)下列过程中不一定释放能量的是AB(请填编号)
(1)下列过程中不一定释放能量的是AB(请填编号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾霾是一种自然现象,对人体健康影响不大 | |
| B. | PM2.5是指大气中直径小于或等于2.5μm的颗粒物 | |
| C. | 大气中SO2含量的增加会导致温室效应加剧 | |
| D. | 酸雨是pH小于7的雨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com