
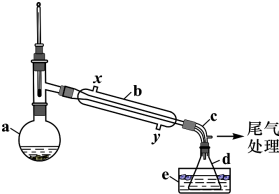
���� ��1�������ܲ�ȡ����ԭ��ͨ������ˮ������Ч���ã�
��2�����Ƭ�Ĵ��ڿ��Է�ֹ�ڼ��ȹ����в�������������������ķе�Ϊ38.4��������Ⱥ�ɫ������Ϊ�嵥�ʣ�����������ԣ�������������������Һ��ȥ��
��3���Ҵ���Ũ������������¼����ܹ��������Ӽ���ˮ���������ѣ����ܹ�������ȥ��Ӧ������ϩ��
��4���ܶȴ�Ĵӷ�Һ©���¿ڷų���������������ܶȴ���ˮ��Һ������
��� �⣺��l����ȡ����ԭ������������ͨ������ˮ���ܹ��������������yͨ������ˮ��
�ʴ�Ϊ��y��
��2�������Һ̬�������������������Ƭ�Ĵ��ڿ��Է�ֹ���ȹ����в�����������������ķе�Ϊ38.4�棬��е�ϵͣ��ӷ�����Ҫ����ƿ���ڱ�ˮԡ����ȴ���£��Ա������ӷ���
d�е����Һ�Դ��Ⱥ�ɫ��������Ϊ�嵥�ʣ��嵥�ʾ��������ԣ�������������NaHSO3��Һϴ�ӳ�ȥ����Ӧ�����ӷ���ʽΪ��Br2+HSO3-+H2O=2Br-+SO42-+3H+��H++HSO3-=SO2��+H2O��Br2+4HSO3-=2Br-+SO42-+3SO2��+2H2O��
�ʴ�Ϊ����ֹ��Һ���ȱ��У�������ķе�ϵͣ���Ҫ��ȴ������ӷ���Br2+HSO3-+H2O=2Br-+SO42-+3H+��H++HSO3-=SO2��+H2O����Br2+4HSO3-=2Br-+SO42-+3SO2��+2H2O����
��3���Ҵ���Ũ������������¼��ȿ��Է�����ȥ��Ӧ������ϩ��CH2=CH2�����ܹ��������Ӽ���ˮ�������ѣ�CH3CH2OCH2CH3��
�ʴ�Ϊ��CH3CH2OCH2CH3��CH2=CH2��
��4����������ܶȴ���ˮ�����л������²㣬Ӧ�ôӷ�Һ©�����¿ڷų���
�ʴ�Ϊ���¿ڷų���
���� ���⿼�����Ʊ���������ƣ���Ŀ�Ѷ��еȣ���ȷʵ��Ŀ�ġ�ʵ��ԭ��Ϊ���ؼ���ע�����շ�Һ�����������ܵ�ʹ�÷���������������ѧ���ķ�����������ѧʵ��������


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������E��F | |
| B�� | �����ʵ�����E��F�ֱ�������ϡ���ᷴӦ���������������ʵ�����E��F | |
| C�� | Ea+��Fb+����ͬ�ĵ��Ӳ�ṹ��a��b�� | |
| D�� | 25��ʱ��Ksp[E��OH��a]��Ksp[F��OH��b] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����£�22gCO2��̼��˫����ĿΪ2NA | |
| B�� | 12.0gNaHSO4�����к���������Ϊ0.1NA | |
| C�� | ��״���£�22.4LBr2������������ΪNA | |
| D�� | 7.8gNa2O2��������ˮ��Ӧת�Ƶ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ˮ��Ӧ��Na+2H2O�TNa++2OH-+H2�� | |
| B�� | �����������O2-+2H+�TH2O | |
| C�� | NaOH��Һ��С�մ���Һ��Ӧ��HCO3-+OH-�TCO32-+H2O | |
| D�� | ����ͨ��ˮ�У�Cl2+H2O?2H++Cl-+ClO- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Y�ļ���̬�⻯����һ�������¿ɱ�Q�������� | |
| B�� | Y�ļ����Ӱ뾶С��Z�ļ����Ӱ뾶 | |
| C�� | Q�ɷֱ���X��Y��Z��W�γɻ�ѧ��������ͬ�Ļ����� | |
| D�� | Z����������Ӧ��ˮ����ֱ���X��Y����������Ӧ��ˮ���ﷴӦ����1molˮʱ���ų���������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al����NaOH��Һ��2Al+2H2O+2NaOH�T2NaAlO2+3H2�� | |
| B�� | ʢ��NaOH��Һ���Լ�ƿ�����ò�������SiO2+2OH-�TSiO32-+H2O | |
| C�� | ��FeCl3��Һ�еμӵ��۵⻯����Һ����Һ������2Fe3++2I-�T2Fe2++I2 | |
| D�� | ���ȵ�Fe˿��ˮ�Ӵ��������γ�����ɫ�����㣺2Fe+3H2O��g�� $\frac{\underline{\;\;��\;\;}}{\;}$ Fe2O3+3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba2+ | B�� | Na+ | C�� | OH- | D�� | Ag+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c ��Na+����c ��HCO3-����c ��CO32-����c��H+����c��OH-�� | |
| B�� | c ��Na+��=c ��HCO3-��+c ��CO32-��+c ��H2CO3�� | |
| C�� | c ��Na+��=c ��HCO3-�� | |
| D�� | c ��Na+��+c��H+��=c ��HCO3-��+2c ��CO32-��+c��OH-��+c��H2CO3�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com