
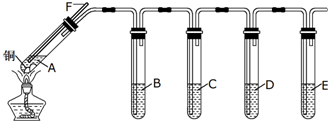
分析 探究SO2的性质实验流程:在装置A中Cu与浓硫酸共热发生反应反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,生成硫酸铜、二氧化硫气体和水,B检验SO2的漂白性,C验证二氧化硫是酸性氧化物,D验证二氧化硫的还原性,E验证二氧化硫的氧化性,装置B用品红溶液检验漂白性,在装置C中SO2与饱和澄清石灰水反应,发生反应:Ca(OH)2+SO2=CaSO3↓+H2O,二氧化硫过量还会发生反应:CaSO3+SO2+H2O=Ca(HSO3)2,在装置D中发生反应:SO2+Ba(NO3)2+2H2O=BaSO4↓+2NO↑+2H2SO4,E中发生反应:2Na2S+5SO2+2H2O═4NaHSO3+3S↓,产生淡黄色沉淀,二氧化硫是过量的,且有毒,污染环境,应进行尾气处理.
解答 解:(1)二氧化硫用铜和浓硫酸在加热的条件下制得,导管F的作用是平衡气压(防止气压过低产生倒吸现象,也防止气压过大)以及反应结束后可以从导管中通入空气,便于排出装置内残余的SO2,
故答案为:浓硫酸;平衡气压(防止气压过低产生倒吸现象,也防止气压过大)以及反应结束后可以从导管中通入空气,便于排出装置内残余的SO2;
(2)在装置D中发生反应:SO2+Ba(NO3)2+2H2O=BaSO4↓+2NO↑+2H2SO4,证明二氧化硫具有还原性,
故答案为:BaSO4;还原;
(3)二氧化硫具有漂白性,用品红溶液检验,
故答案为;B;
(4)始终未见C中饱和澄清石灰水出现浑浊或沉淀,SO2产生的快而多且溶解度较大,Ca(OH)2溶解度很小,饱和石灰水浓度小,导致迅速生成Ca(HSO3)2,反应方程式为:CaSO3+SO2+H2O=Ca(HSO3)2,Ca(HSO3)2易溶于水,验证溶液中的Ca(HSO3)2,取适量反应后C中的溶液,向其中加入氢氧化钠溶液,观察是否有沉淀生成即可,
故答案为:SO2产生的快而多且溶解度较大,Ca(OH)2溶解度很小,饱和石灰水浓度小,导致迅速生成Ca(HSO3)2溶液;取适量反应后C中的溶液,向其中加入氢氧化钠溶液,观察是否有沉淀生成;
(5)E中发生反应:2Na2S+5SO2+2H2O═4NaHSO3+3S↓,产生淡黄色沉淀,证明二氧化硫有氧化性,
故答案为:溶液中出现淡黄色浑浊;
(6)二氧化硫是过量的,且有毒,污染环境,应进行尾气处理,
故答案为:缺少尾气处理装置.
点评 本题考查二氧化硫的制取、性质、尾气处理以及实验装置评价,为高频考点,二氧化硫具有漂白性、氧化性和还原性,根据试剂性质确定检验目的,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 物质 | MgCO3 | Li2CO3 | Mg(OH)2 |
| Ksp | 6.82×10-6 | 8.2×10-4 | 5.6×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A(A-x+n)}{W}mol$ | B. | $\frac{w(A+x-n)}{A}mol$ | C. | $\frac{w(A-x+n)}{A}mol$ | D. | $\frac{w(A-X-N)}{A}mol$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | B. | 酸性:H2CO3>HClO | ||
| C. | 氧化性:浓硝酸>稀硝酸 | D. | 结合OH-的能力:NH4+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ |
| 原子半径/nm | 0.037 | 0.110 | 0.077 | 0.099 | 0.186 |
| 部分化合价 | +1 | -3+5 | -4+4 | -1 | +1 |
| A. | ④是周期表中非金属性最强的元素 | |
| B. | ①是周期表中原子半径最小的元素 | |
| C. | ②④⑤在位于同一个周期 | |
| D. | ①③两元素组成的最简单化合物分子与③④两元素组成的化合物分子空间构型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com