
(1)用托盘天平称量一药匙NaOH的质量,操作步骤如下:①调零点,使指针在标尺左右摆动,静止时指针处于标尺正中间;②将游码拨在刻度尺零处;③将一药匙NaOH放在小烧杯内,并进行称量;④称量小烧杯的质量;⑤把砝码放回砝码盒内;⑥记录称量的结果。
正确的操作步骤的顺序(有些操作可重复)是________。
(2)在下列实验操作中,需要用到托盘天平的是________(填字母)。
A.用NaCl来配制250mL0.2mol·L-1的NaCl溶液;
B.用浓盐酸(![]() =1.19g·cm-3)配制250mL0.5mol•L-1的稀盐酸;
=1.19g·cm-3)配制250mL0.5mol•L-1的稀盐酸;
C.测定KNO3的溶解度;
D.用胆矾来配制200g溶质的质量分数为2%的CuSO4溶液;
E.用标准浓度的HCl溶液滴定未知浓度的NaOH溶液。
(3)如图是某学生在称量NaOH固体时,使用天平的操作示意图,其中的错误之处是(不一定填满):①________;②________;③________。

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
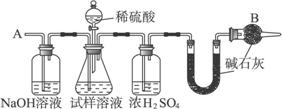
主要实验步骤如下:①按图组装仪器,并检验装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,得到b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请填空和完成下列问题:
(1)在用托盘天平称量药品时,如果天平的指针向左偏转,说明__________________________。
(2)装置中干燥管B的作用是________________________________________________。
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果___________(填“偏高”“偏低”或“不变”)。
(4)步骤⑤的目的是________________________________________________________。
(5)步骤⑦的目的是________________________________________________________。
(6)试样中纯碱的质量分数的计算式为_________________________________________。
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)_________。向上述溶液中滴入过量的CaCl2溶液,观察到的现象是__________________。
Ⅱ.某天然碱的组成为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数)。现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为

请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明_______________________。
(2)NaHCO3受热分解的化学反应方程式为________________________________________。
(3)E处碱石灰的作用是__________________________________________________。
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是__________________。
(5)实验结束后称得洗气瓶C质量增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com