
下列说法正确的是
| A.原子的第一电离能越大,该元素的电负性就越大 |
| B.原子的电子层数越多,原子半径越大 |
| C.原子失去电子越多,说明其还原性越强 |
| D.同一原子的能层越高,S电子云的半径越大 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
已知X、Y、Z、L四种元素是组成蛋白质的基础元素且原子序数依次增大。回答下列问题:
(1)L的元素符号为________ ;Y元素原子核外电子中,未成对电子数与成对电子数之比为______;四种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3可构成分子A,A的电子式为________;B分子也由Z、X两元素组成,作为运送飞船的火箭燃料,常温下是一种液态化合物。已知该化合物的相对分子质量为32,其中X元素的质量分数为12.5 %,且该分子结构中只有单键。则B的结构式为____________。若64 g B分子与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,还放出3000 kJ的热量,写出该反应的热化学方程式 。
(3)硒(Se)是人体必需的微量元素,与元素L同一主族,该族第2 ~5周期元素单质分别与H2反应生成l mol气态氢化物产生的热量数据如下,其中能表示生成1 mol硒化氢所产生的热量的是__________(选填字母编号)。
a.—99.7 kJ b.—29.7 kJ c.+20.6 kJ d.+241.8 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
A.电子层结构相同的不同离子,其半径随核电荷数增大而减小
B.C、O、S原子半径依次增大,氢化物稳定性逐渐增强
C.I A族元素与ⅦA元素形成的化合物都为离子化合物
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
元素的原子结构决定其性质和在周期表中的位置,下列说法正确的是
| A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
B.某微粒的结构示意简图为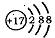 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 |
| C.Be(OH)2的碱性比Mg(OH)2的碱性强 |
| D.原子半径:Na>Si>O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
A.H与D,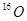 与 与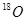 互为同位素: 互为同位素: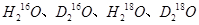 互为同素异形体 互为同素异形体 |
| B.元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y |
| C.质量数相同的不同核素,一定属于不同种元素 |
D.常温下,在pH=1的溶液中,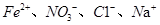 能够大量共存 能够大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强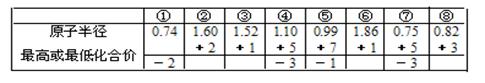 |
B.图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2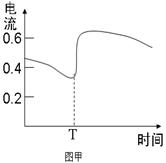  |
| C.图乙表示某一放热反应,若使用催化剂E1、E2、ΔH都会发生改变 |
| D.表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H= -571.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表为六种短周期元素的部分性质。
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.37 | 0.74 | 0.75 | 0.82 | 0.99 | 1.10 |
| 主要化合价 | +1 | -2 | +5、-3 | +3 | +7、-1 | +5、-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图为短周期的一部分,Y原子最外层电子数是其电子层数的2倍,下列说法正确的是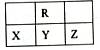
| A.Y的氢化物比Z的氢化物稳定 |
| B.原子半径大小顺序是X >Y>R |
| C.Y、R形成的化台物YR2能使酸性KMnO4溶液褪色 |
| D.四种元素中最高价氧化物的水化物的酸性最强的是Y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法错误的是
A.分子在化学反应中可以再分,原子在化学反应中不可再分
B.氧化性酸具有氧化性,还原性酸不具有氧化性
C.胶体、溶液、浊液均为混合物,电解质、非电解质均为化合物
D.12C、13C、14C为碳元素的三种核素,金刚石、石墨互为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com