
ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目_______________________。
科目:高中化学 来源: 题型:
下列各组中的X和Y两种原子,化学性质一定相似的是 ( )。
A.X原子和Y原子最外层都只有1个电子
B.X原子的核外电子排布式为1s2,Y原子的核外电子排布式为1s22s2
C.X原子的2p能级上有3个电子,Y原子的3p能级上有3个电子
D.X原子核外M层上仅有2个电子,Y原子核外N层上仅有2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列标明电子转移的方向和数目的化学方程式中正确的是-----;其中属于歧化反应的是---,属于归中反应的是-----,属于部分氧化还原反应的是-----。
①2KClO3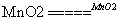 2KC得6e-l+3O失6e-2↑
2KC得6e-l+3O失6e-2↑
②Cl2+2NaOH===NaC失2e-l+NaC得2e-lO+H2O
③6HCl(浓)+KClO3===KC得6e-l+3C失6e-l2↑+3H2O
④4HCl(浓)+M2e-nO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑤Cu+4HN2e-O3(浓)===Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3—→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol,则下列判断正确的是 ( )
A.生成40.0 L N2(标准状况)
B.有0.250 mol KNO3被氧化
C.转移电子的物质的量为1.25 mol
D.被还原的N原子的物质的量为3.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列溶液中发生如下反应:
①16H++10Z-+2XO ===2X2++5Z2+8H2O
===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
由此判断下列说法正确的是( )
A.反应Z2+2A2+===2A3++2Z-不能进行
B.Z元素在①③反应中均被氧化
C.氧化性由弱到强的顺序是XO 、Z2、B2、A3+
、Z2、B2、A3+
D.还原性由强到弱的顺序是A2+、B-、Z-、X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,氧化产物为________,若有3 mol FeS2参加反应,转移________mol电子。
6SO2+Fe3O4,氧化产物为________,若有3 mol FeS2参加反应,转移________mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为_______________________________
____________(用离子方程式表示)。
③FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________________。
(2)已知:S2O 有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为
有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为
S2O +2I-===2SO
+2I-===2SO +I2①
+I2①
I2+2S2O ===2I-+S4O
===2I-+S4O ②
②
S2O 、S4O
、S4O 、I2氧化性强弱顺序:______________________。
、I2氧化性强弱顺序:______________________。
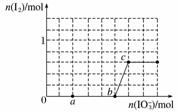
(3)已知溶液中,还原性为HSO >I-,氧化性为IO
>I-,氧化性为IO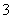 >I2>SO
>I2>SO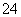 。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
①a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是_________________________________。
②当溶液中的I-为0.5 mol时,加入的KIO3可能是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则( )
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg
D.转移的电子总数为6×10-5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com