
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图,有关说法不正确的是( )
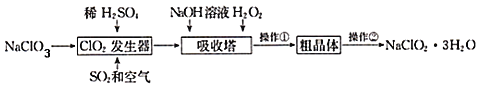
A.NaOH的电子式为![]()
B.加入的H2O2起氧化作用
C.ClO2发生器中发生反应的离子方程式为2ClO3﹣+SO2 ═2ClO2+SO42﹣
D.操作②实验方法是重结晶
【答案】B
【解析】
ClO2发生器中发生反应生成ClO2和NaHSO4,反应后通入空气,可将ClO2赶入吸收器,加入NaOH、过氧化氢,可生成NaClO2,过氧化氢被氧化生成氧气,经冷却结晶、重结晶、干燥得到NaClO2.3H2O,以此解答该题。
A.书写电子式时原子团用中括号括起来,NaOH的电子式![]() ,故A正确;
,故A正确;
B.在吸收塔中二氧化氯生成亚氯酸钠,氯元素化合价由+4变为+3,化合价降低做氧化剂,有氧化必有还原,H2O2做还原剂起还原作用,故B不正确;
C.ClO2发生器中发生反应的离子方程式为2ClO3﹣+SO2 ═2ClO2+SO42﹣,故C正确;
D.将粗晶体进行精制,可以采用重结晶,故D正确;
故选:B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硒(Se)及其化合物在工农业生产中有许多用途。以铜阳极泥(主要成分为Ag2Se、Cu2Se和银、金、铂等)为原料制备纯硒的工艺流程如图所示:
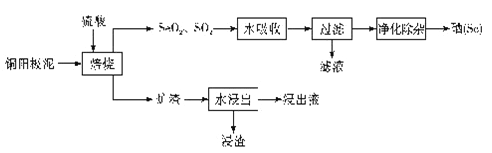
回答下列问题:
(1)“焙烧”时的硫酸浓度最好为_____(填标号)。
A.浓硫酸 B. 20%硫酸 C.50%硫酸 D. 80%硫酸
(2)“焙烧”过程中Cu2Se参与反应时,该反应的氧化产物是_______。
(3)“水吸收”所发生反应的化学方程式为____________。
(4)“过滤”所得粗硒可采用真空蒸馏的方法进行提纯,获得纯硒。真空蒸馏的挥发物中硒含量与温度的关系如图所示:
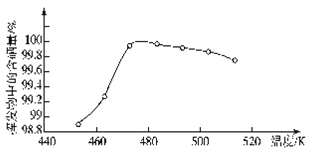
蒸馏操作中控制的最佳温度是_____(填标号)。
A.455℃ B.462℃ C.475℃ D.515℃
(5)“水浸出”中的炉渣需粉碎,且加入温水进行浸泡,目的是____________________,“浸渣”中含有的金属单质是___________。
(6)若“浸出液”中,c(Ag+)=3.0×10-2 mol/L,则溶液中c(SO42-)最大为___________________(已知:Ksp(Ag2SO4)=1.4×10-5,计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
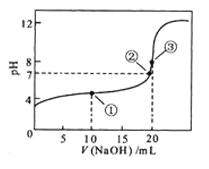
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是
A. C的体积分数增大了 B. A的转化率降低了
C. 平衡向正反应方向移动 D. x+y<z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3的分解有催化作用:
O3+Cl=ClO+O2 ΔH1
ClO+O=Cl+O2 ΔH2
该反应的能量变化如图所示,下列叙述中正确的是( )

A.反应O3+O=2O2的ΔH=E1-E2
B.反应O3+O=2O2的ΔH=E2-E3
C.反应O3+O=2O2是吸热反应
D.反应O3+O=2O2的ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气污染物的处理,对缓解和治理环境污染、保护我们赖以生存的地球,具有十分重要的意义。
(1)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5/kJmol
N2(g)+O2(g)═2NO(g)△H=+180kJ/mol
则C(s)+2NO(g)═CO2(g)+N2(g) 的△H=_____kJ/mol。
(2)在一定温度下,向2L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)4CO2(g)+N2(g),测得相关数据如表所示:
t/min | 0 | 5 | 10 | 15 | 20 |
n(NO2)/mol | 4.0 | 3.4 | 3.12 | 3.0 | 3.0 |
n(N2)/mol | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
①在0~5 min内,用CO2的浓度变化表示的反应速率为_____。
②此温度下的化学平衡常数K的表达式为_____。
(3)用活性炭还原法处理氮氧化物,有关反应为C(s)+2NO(g)![]() CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
CO2(g)+N2(g)。某研究小组向2L密闭容器中加入足量的活性炭和一定量的NO,保持温度和体积不变,发生上述反应。
①下列描述能说明上述反应已达平衡的是_____(填标号)。
A.活性炭的质量不再变化
B.容器中气体的密度保持不变
C.2v(NO)正 =v(N2)逆
D.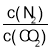 保持不变
保持不变
②压强为p时,催化剂的催化效率、氮气的生成速率与温度的关系如图所示。当氮气的生成速率主要取决于温度时,对应的温度范围是_____。

(4)肼(N2H4)是无色液体,具有强还原性。
①肼的水溶液显弱碱性,其电离过程与NH3H2O类似,则第一步电离方程式为_____。
②新型N2H4燃料电池产物对环境没有污染,该电池以固体氧化物为电解质(能传导O2﹣)。写出负极的电极反应式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线____填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g)![]() CH3OH(g)的△H= _________________________ 。
CH3OH(g)的△H= _________________________ 。
(2)下列说法正确的是 (_________)
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,υ(CO)= _______;达到平衡时,c(H2)= ____ ,该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数为______________。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________移动 (填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理含氮的化合物,在生产、生活中有重要意义。回答下列问题:
(1)在紫外光照射的条件下,氯气与偏二甲肼[(CH3)2NNH2]可快速反应,偏二甲肼转化为CH3OH和N2,该反应的化学方程式为______________________________。
(2)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。25℃时,连二次硝酸的电离常数Ka1=6.17×10-8,Ka2=2.88×10-12
①25℃时0.1molL-1NaHN2O2溶液中离子浓度由大到小的顺序为____________________________。
②25℃时向0.1 molL-1连二次硝酸溶液中逐滴滴入NaOH溶液,当溶液的pH=10时,C(N2O22-)/ C(H2N2O2)=________。
(3)亚硝酰氯可由NO与Cl2反应制得,反应原理为2NO(g)+ Cl2 (g)![]() 2C1NO(g)。按投料比n(NO):n(Cl2) =2:1把NO和Cl2充入一恒压的密闭容器中发生上述反应,NO的平衡转化率与温度T的关系如图所示:
2C1NO(g)。按投料比n(NO):n(Cl2) =2:1把NO和Cl2充入一恒压的密闭容器中发生上述反应,NO的平衡转化率与温度T的关系如图所示:
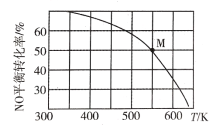

①该反应的△H_____(填“>”“<”或“=”)0。
②M点时容器内NO的体积分数为____。
③若反应一直保持在P压强条件下进行,则M点的平衡常数Kp=____________,(用含P的表达式表示)。
(4)工业上电解NO制备NH4NO3可以变废为宝,其工作原理如图所示、电解时阳极反应式为___________,为使电解产物全部转化为NH4NO3,需要补充物质A,物质A化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com