
下列事实不能用化学平衡移动原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
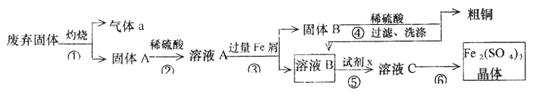
(1)除酒精灯和铁架台或三脚架外,①中所需的容器为_______;①和⑥中都用到的玻璃仪器为______________;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol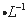 硫酸、1.0 mol
硫酸、1.0 mol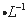 NaOH溶液、0.1 mol
NaOH溶液、0.1 mol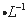 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
电子表所用纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液。其电极反应是:
Zn+2OH-—→ZnO+H2O+2e-
Ag2O+H2O+2e-—→2Ag+2OH-
总反应式为:Ag2O+Zn===2Ag+ZnO
下列判断正确的是( )
①锌为正极,Ag2O为负极
②锌为负极,Ag2O为正极
③原电池工作时,负极区溶液pH减小
④原电池工作时,负极区溶液pH增大
A.①② B.①③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定量的Cu(NO3)2溶液,下列说法中正确的是( )
A.阳极发生的电极反应为Cu2++2e-====Cu
B.阴极发生的电极反应为4OH--4e―====2H2O+O2↑
C.若有6.4 g金属Cu析出,放出的O2一定为0.05 mol
D.电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
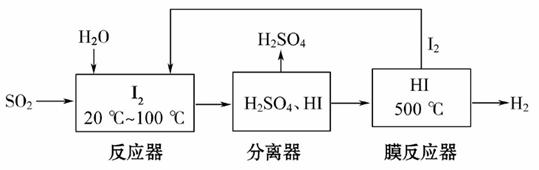
请回答下列问题:
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为
________________________________________。
(2)该循环工艺过程的总反 应方程式为__________________________________。
应方程式为__________________________________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是__________________________________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
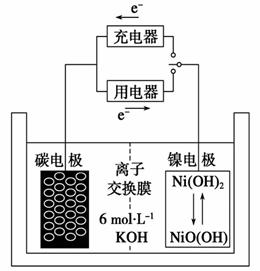
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)1/2N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com