
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl—+HClO
H++Cl—+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-= AgCl↓
A.①②③④⑤B.①②③C.②③D.③
科目:高中化学 来源: 题型:
【题目】活性炭吸附法是工业提碘的主要方法之一,其流程如图:
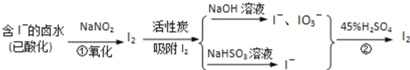
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I﹣氧化为I2,同时生成NO.写出反应①的离子方程式______.
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I﹣选择了价格并不便宜的亚硝酸钠,可能的原因是______.
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是______.
(4)流程中,碘元素经过了I﹣→I2→I﹣、IO3﹣→I2的变化过程,这样反复操作的目的是______.
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在以下两种程度不同的平衡体系:
①水解______和电离______(用离子方程式表示)
②如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
加入少量Ba(OH)2固体,水解平衡向______移动;加入少量NaClO固体,溶液的pH______(选填:增大、减小、不变).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
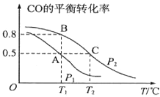
①A、B两点对应的压强大小关系是PA___PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是___。
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=___。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___v(逆)(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃硝酸钾饱和溶液先升温至80℃,在恒温下蒸发部分溶剂至析出少量溶质,然后将溶液逐渐冷却至60℃.下列示意图中能正确表示整个过程中溶液浓度a%与时间t关系的是( )
A.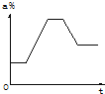 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
【1】硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
【2】向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。____
【3】为了使Na2S溶液中![]() 的比值变小,可适量加入(或通入)的物质是_______。
的比值变小,可适量加入(或通入)的物质是_______。
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物____________(填“相同”或“不同”),由此可知硫酸氧化性的强弱与______________有关。
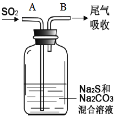
【4】在如图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)________ H2S,原因是__________。
【5】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
温度(℃) | c(氨水)(mol/L) | 电离程度(%) | c(OH-)(mol/L) |
0 | 16.56 | 9.098 | 1.507×10-2 |
10 | 15.16 | 10.18 | 1.543×10-2 |
20 | 13.63 | 11.2 | 1.527×10-2 |
表中c(OH-)基本不变的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构简式如图所示,与氢气发生加成反应得到物质甲,下列有关说法不正确的是

A.有机物M含有2种官能团
B.有机物M的分子式为C4H6O2
C.有机物M能发生取代反应、加聚反应
D.甲只含有一种官能团的链状同分异构体(不含甲本身)有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO3)2,其部分工艺流程如下:
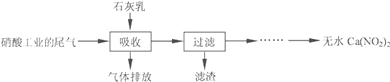
(1)硝酸工业尾气一般用碱液吸收,写出一个吸收尾气离子方程式_____.
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是___;滤渣可循环利用,滤渣的主要成分是____(填化学式).
(3)该工艺需控制NO和NO2物质的量之比接近1:1.若n(NO):n(NO2)>1:1,则会导致____;若n(NO):n(NO2)<1:1,则会导致_____.
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.95℃纯水显中性,故pH=7
B.稀释弱电解质溶液时,溶液中所有粒子浓度都减小
C.pH试纸在使用之前应用蒸馏水润湿
D.室温下,向10 mL pH=3的醋酸溶液中加水稀释后,溶液中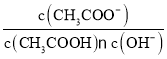 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)CO2(g)+N2(g)+Q,平衡时c (NO)与温度T的关系如图所示,则下列说法正确的是
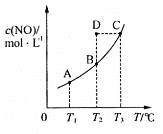
A.该反应的Q >0
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时V正>V逆
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com